Průlom v léčbě obstrukční HCM

Hypertrofická kardiomyopatie (HCM) je geneticky podmíněné onemocnění myokardu, které je charakterizováno ztluštěním stěny levé komory bez přítomnosti jiného zjevného důvodu, jako je arteriální hypertenze nebo aortální stenóza. Jde o onemocnění, které patří mezi nejčastější příčiny náhlé smrti u osob do 35 let. Vyskytuje se s prevalencí 1 : 500 až 1 : 200 a základním diagnostickým nástrojem je echokardiografie, která ale může mít svá úskalí. Nejen na ně cílilo odborné sympozium konané v rámci letošního výročního sjezdu České kardiologické společnosti. Tématem byla také moderní terapie HCM a úkoly regionů a specializovaných center v managementu pacientů s HCM.
Sympozium věnované HCM, podpořené společností Bristol‑Myers Squibb, se konalo v pondělí 5. května, tedy v době, kdy vrcholil letošní, již XXXIII. výroční sjezd České kardiologické společnosti (ČKS). Odborný program otevřel prof. MUDr. Aleš Linhart, DrSc., místopředseda ČKS a přednosta II. interní kliniky – kliniky kardiologie a angiologie 1. LF UK a VFN Praha. Věnoval se problematice dlouhodobé účinnosti terapie mavakamtenem u pacientů s HCM.
Mavakamten mění průběh HCM a zlepšuje symptomy a kvalitu života
HCM je genetické onemocnění, při němž na podkladě různých mutací vzniká strukturální defekt na srdci. Od roku 2014 je HCM definována jako onemocnění charakterizované zesílením jednoho či více segmentů levé komory o ≥ 15 mm, jež není vysvětlitelné tlakovým zatížením (arteriální hypertenze, aortální stenóza). U přímých příbuzných a geneticky pozitivních jedinců jde o hodnotu již ≥ 13 mm. Jednou z komplikací HCM je náhlá srdeční smrt, jejíž riziko postupně klesá s věkem, aby ovšem bylo nahrazeno rozvojem srdečního selhání a samozřejmě i dalších komplikací, nejenom kardiovaskulárních (Lorenzini et al., JAMA Cardiol. 2020). „Přestože hypertrofická kardiomyopatie zaznamenala v posledních letech určitý posun ve spektru potíží pacientů, protože diagnostikujeme dříve, je pravdou, že to je choroba, která významným způsobem limituje osud našich nemocných – zásadní faktor tady představuje přítomnost obstrukce výtokového traktu levé komory,“ konstatoval prof. Linhart. Obstrukci LVOT nemají zdaleka všichni pacienti. Studie kohorty pacientů z USA (Maron, Circulation 2006) ukazuje, že tzv. klidová obstrukce se vyskytla u přibližně 37 procent pacientů. Obstrukce při zátěži, tzv. provokabilní obstrukce, byla přítomna u dalších třiatřiceti procent osob. Jak zdůraznil prof. Linhart, právě pacienti s obstrukcí mají velkou šanci vyvinout srdeční selhání.
Cestu ven z problému může představovat blokáda srdečního myosinu. Mavakamten je první selektivní, alosterický a reverzibilní inhibitor srdečního myosinu. Moduluje počet myosinových hlavic, které mohou vstupovat do stavu vzniku kontrakce, čímž snižuje (nebo u HCM normalizuje) pravděpodobnost tvorby systolických a reziduálních diastolických příčných můstků při kontrakci a také posouvá veškerý myosin do energeticky úsporného, superrelaxovaného stavu, který je však možné ihned aktivovat. U pacientů s HCM inhibice srdečního myosinu pomocí mavakamtenu normalizuje kontraktilitu, snižuje dynamickou obstrukci LVOT a zlepšuje plnicí tlaky srdce. „Jsme tak schopni vylepšit symptomy našich pacientů,“ doplnil prof. Linhart. Dosud rutinně používané léky, především betablokátory a blokátory kalciových kanálů, mají oproti mavakamtenu relativně limitovaná data. Data s mavakamtenem jsou podle slov prof. Linharta revoluční. První krátkodobé výsledky byly publikovány před pěti lety (Olivotto et al., Lancet 2020). EXPLORER‑HCM, pivotní randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická studie fáze III zkoumala účinek mavakamtenu u 251 symptomatických pacientů s HCM s obstrukcí LVOT ve 13 zemích světa. Pacienti s gradientem LVOT ≥ 50 mm Hg a symptomy třídy NYHA II až III byli randomizováni v poměru 1 : 1 do ramene s mavakamtenem jednou denně (s počáteční dávkou 5 mg následovanou titrací dávky) nebo placebem podávaným po dobu 30 týdnů. Na konci randomizované fáze byl wash‑out, pak následovala fáze, kdy všichni pacienti dostali mavakamten. V rameni s mavakamtenem bylo pozorováno zvýšení pVO2 o ≥ 1,5 ml/kg/min a zlepšení NYHA o ≥ 1 třídu nebo zvýšení pVO2 o > 3,0 ml/kg/min bez zhoršení NYHA u 37 procent pacientů oproti 17 procentům v placebovém rameni (p = 0,0005) po 30 týdnech léčby. „Obstrukční gradient významným způsobem klesá, prakticky na polovinu, proti placebu a není to doprovázeno rizikem rozvoje systolické dysfunkce. To byla ve skutečnosti poměrně vzácná komplikace,“ komentoval prof. Linhart a dodal, že je namístě připomenout i další efekty léčby, například změnu NT‑proBNP, který při terapii mavakamtenem dramaticky klesá. Klesají také koncentrace vysoce senzitivního troponinu. Mavakamten by neměl být vysazován, pokud jej pacienti tolerují. Ve studii bylo vysazení mavakamtenu spojeno se zhoršením kvality života a zhoršením dušnosti, což ukázaly validované nástroje (např. KCCQ).
Součástí léčby mavakamtenem je sledování ejekční frakce (EF) levé komory. U devíti pacientů ve studii EXPLORER‑HCM došlo během léčby k reverzibilnímu snížení EF < 50 procent, sedm z těchto pacientů bylo z mavakamtenové skupiny, dva z placebové. U tří ze sedmi pacientů léčených mavakamtenem a u jednoho ze dvou pacientů léčených placebem nebylo toto snížení klinicky zjevné. U všech sedmi pacientů léčených mavakamtenem došlo nicméně po ukončení léčby mavakamtenem ke zlepšení EF levé komory.
Další zajímavé výsledky přinesla studie MAVA‑LTE (Rader et al., J Am Coll Cardiol HF 2024), dávkově zaslepená dlouhodobá bezpečnostní rozšířená studie, jež byla provedena u pacientů, kteří dokončili buď MAVERICK‑HCM, proof‑of‑concept studii u neobstrukční HCM, nebo zmíněnou EXPLORER‑HCM. „Pokles gradientu ve výtokovém traktu byl nejen prokazatelný v časné fázi, ale setrvale, a dokonce ještě výrazněji, pokračoval dál v čase. Je docela zajímavé, že se také zmenšil objem levé síně. Pokles natriuretických peptidů byl na začátku výrazný a pak setrvalý a ejekční frakce se u pacientů nehoršila, ale zůstávala dlouhodobě stabilní,“ shrnul výsledky prof. Linhart. Studie VALOR‑HCM (Desai et al., Am Heart J 2021) doložila, že léčba mavakamtenem významně snižuje potřebu invazivního výkonu, redukční ablace septa (SRT). Byla to multicentrická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III, která srovnávala působení mavakamtenu (v dávce 2,5–15 mg denně) s placebem dohromady u 112 pacientů doporučených k SRT. Pacienti byli randomizováni buď k mavakamtenu (1. až 32. týden), nebo placebu (1. až 16. týden), přičemž v placebové skupině proběhl následně cross‑over na mavakamten (týdny 16. až 32.). Dále pak všichni pacienti pokračovali léčbou mavakamtenem až do 128. týdne. U pacientů bylo pozorováno snížení pozátěžového gradientu LVOT o 37 mm Hg a zlepšení NYHA o ≥ 1 třídu u 41 procent jedinců. U dvou pacientů léčených mavakamtenem bylo hlášeno snížení EF na méně než 50 procent, z čehož se ale po vysazení léčiva na dobu čtyř týdnů zotavili. Pacienti na mavakamtenu měli obecně vyšší skóre KCCQ‑23, v průměru 80 versus 67 u placeba. Co se týče nežádoucích účinků, ve skupině s mavakamtenem nebyla zjištěna žádná ventrikulární tachykardie ve srovnání s devíti procenty ve skupině s placebem. Mírné nežádoucí účinky byly vyšší u pacientů užívajících mavakamten proti placebu. U žádného pacienta nebyly zaznamenány závažné nežádoucí účinky kromě dvou pacientů zmíněných výše. „Pokud si shrneme výsledky týkající se indikace SRT, z původních 100 procent osob indikovaných k SRT zůstalo v mavakamtenové větvi indikováno jen 18 procent během časné randomizované fáze do 16. týdne. A když se pokračovalo v terapii dál, bylo to již jen devět procent indikovaných k SRT v 56. týdnu. Ve skupině placebo/cross‑over to bylo v 16. týdnu 77 procent a v 56. týdnu to bylo 19 procent. Je evidentní, že pacienti, kteří zde byli velmi těžcí a velmi symptomatičtí, profitují z terapie mavakamtenem. Došlo u nich ke zlepšení symptomatologie a vylepšila se třída NYHA, a to velmi výrazně, stejně tak gradient a koncentrace natriuretických peptidů a troponinu,“ popsal prof. Linhart a dodal: „Zdá se, že v dlouhodobém horizontu dochází k remodelaci levé komory. Na echokardiografii vidíme, že hmota levé komory se snižuje a také se zlepšují diastolické indexy a zmenšuje se levá síň. Není tedy vyloučeno, že při léčbě bude docházet ke strukturálním změnám, které budou pro pacienty znamenat také benefit z hlediska kvality života. A když se zeptáme, zda také dochází ke snížení morbidity, respektive mortality, tak odpověď zní, že nevíme. V takto krátkých časových horizontech a na těchto skupinách pacientů nemůžeme prokázat redukci mortality a asi to nebude možné nikdy.“
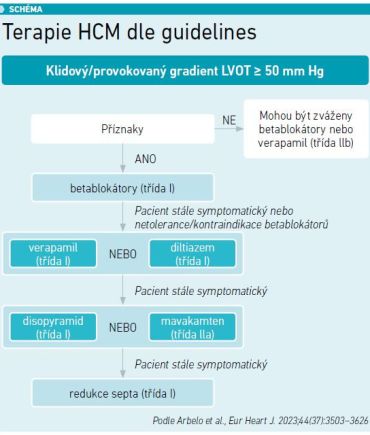
V aktuálních evropských guidelines (Arbelo et al., Eur Heart J 2023) sice stále dominují betablokátory, verapamil, diltiazem a disopyramid jako léky třídy I a mavakamten je ve třídě IIa, podle prof. Linharta však mavakamten disponuje daty, která jej nepochybně časem posunou do třídy I (viz schéma). „Je potřeba říci, že to je terapie, která bude vyžadovat centralizovanou péči a určité specializované sledování. Za prvé, titrace není úplně jednoduchá, jak ukazuje titrační schéma. Postup se odvíjí podle výše gradientu, řeší, jak postupovat u pomalých, středních, rychlých a utrarychlých metabolizérů a podobně. Titruje se také podle toho, jestli dochází k poklesu ejekční frakce. Tudíž určitou expertizu léčba mavakamtenem vyžaduje, stejně jako dlouhodobé sledování pacientů. Například každých 12 týdnů by pacient měl absolvovat echokardiografické vyšetření, byť jenom zjednodušené,“ upozornil prof. Linhart.
Lze shrnout, že mavakamten coby inhibitor myosinu je efektivním řešením i pro nejtěžší pacienty s obstrukcí LVOT, potenciálně indikované k septální redukční léčbě, což v podmínkách ČR dominantně znamená k septální alkoholové ablaci. Ukázalo se, že efekt léčby mavakamtenem přetrvával i v dlouhodobých extenzích klinických studií při zachování dobré bezpečnosti. Je důležité i to, že většina nemocných na léčbě mavakamtenem se již nekvalifikuje k septální redukční terapii. Podávání terapie mavakamtenem vyžaduje pravidelnou monitoraci EF (po 12 týdnech), v udržovací fázi mají být pacienti hodnoceni jednou za šest měsíců.
Echokardiografie v diagnostice a sledování HCM
Doc. MUDr. Petr Kuchynka, Ph.D., z II. interní kliniky – kliniky kardiologie a angiologie 1. LF UK a VFN Praha připomněl, že o diagnostice a managementu HCM pojednávají hned dvoje aktuální guidelines, evropské z roku 2023 (Arbelo et al., Eur Heart J 2023) a guidelines zaměřené přímo na HCM z roku 2024 (Ommen et al., Circulation 2024). Podle doc. Kuchynky jsou ohledně role echokardiografie v souladu. Echokardiografie pomáhá v diagnostice a sledování poměrně komplexně (hodnocení hypertrofie, její distribuce a tíže, detekce obstrukce, její lokalizace a její typ, zjišťování přítomnosti aneurysmat levé komory, hodnocení systolické funkce levé komory, evaluace chlopenních vad, zejména mitrální regurgitace, stanovení velikosti levé síně, analýza dalších obvyklých parametrů – DD, PH, PEEX atd.). „U HCM je výhodou kombinace více projekcí, hlavně parasternální na dlouhou osu a parasternální na krátkou osu – ta je vysloveně u HCM doporučována,“ řekl doc. Kuchynka a doplnil, že pokud to lze, je vhodné skenovat od báze po apex. Obtížné bývá hodnocení anterolaterální oblasti LK a jejího hrotu. Dodal také, že hypertrofie může mít různou distribuci, jak dokládá např. práce z Mayo Clinic (Binder et al., 2006). Ta rozlišuje HCM podle rozložení hypertrofie na sigmoidální, reverzní, apikální a neutrální. To, že aneurysmata LK jsou obtížně detekovatelná echokardiograficky, ukázala práce autorů Maron et al. (Circulation 2008), kdy se echokardiografická detekce aneurysmatu podařila jen v 57 procentech případů. Lepším diagnostickým nástrojem je tudíž v těchto případech magnetická rezonance.
Echokardiografie má důležitou roli i v dalším sledování vývoje onemocnění, např. i pro titrování mavakamtenu – umožňuje hodnocení systolické funkce LK (měření ejekční frakce). Podle doc. Kuchynky má většina jedinců EF normální nebo tzv. supranormální, nevzácně se pohybuje mezi 65–75 procenty, problém ale je, že EF ne vždy dobře odráží reálnou kontraktilitu. „Pokud mají jedinci s HCM ejekční frakci nižší než 50 procent, nejedná se o stejný nález jako u běžné populace, kde bychom hovořili o lehkém snížení systolické funkce. Tady se jedná už o poměrně těžkou kontraktilní dysfunkci, která se označuje jako end‑stage HCM,“ vysvětlil doc. Kuchynka a dodal, že se vyskytuje asi v osmi procentech případů (Marstrand et al., Circulation 2020). Echokardiografie se využívá také pro stratifikaci rizika náhlé srdeční smrti (SCD), je důležitá pro rozhodnutí o zahájení terapie ICD, kdy se do speciálního kalkulátoru zadávají některé parametry z echokardiografie (Elliott et al., Eur Heart J 2014). Barevná dopplerovská echokardiografie může výrazně upozornit na to, zda jedinci s HCM mají, nebo nemají obstrukci. „V místě obstrukce nacházíme turbulenci a často se jedná o obstrukci v LVOT. Klidově má obstrukci zhruba třetina pacientů, a jak už bylo řečeno, u další třetiny ji lze vyvolat, ať již Valsalvovým manévrem, nebo zátěžovou echokardiografií. Klasifikujeme tíži obstrukce, za arbitrární hodnotu se považuje aspoň 50 mm Hg,“ uvedl doc. Kuchynka a své sdělení uzavřel slovy, že echokardiografie je zobrazovací metodou první volby v diagnostice, sledování a managementu nemocných s HCM, nicméně u všech nemocných s HCM by přitom mělo být doplněno i vyšetření MR.
Jak z regionu do centra?
Podle doc. MUDr. Jiřího Bonaventury, Ph.D., z Kardiologické kliniky 2. LF UK a FN Motol Praha je jednou z hlavních výzev stanovení správné diagnózy HCM. „Pokud máme stanovenu diagnózu HCM, měli bychom také správně stanovit diagnózu obstruktivní formy, která má určité léčebné konsekvence,“ uvedl. Při diagnostikování obstrukce by měla být nasazena léčba první linie, která se ale netýká jen obstrukce, ale např. i prevalentní fibrilace síní. Dalším úkolem je stratifikace rizika SCD a doporučení ICD – tento úkol bude podle doc. Bonaventury patřit spíše do center. Dále by se nemělo zapomínat na screening příbuzných. Jak už bylo řečeno, HCM je do velké míry dědičné onemocnění, proto je vždy důležité provést kaskádový screening u prvostupňových příbuzných.
 Doc. Bonaventura dále upozornil na úskalí stanovení diagnózy HCM, které leží už v samotné definici. Definice HCM je zavedena již několik dekád – hypertrofie stěn bez vysvětlující hemodynamické příčiny a tloušťka stěny 15 mm, resp. 13 mm u geneticky pozitivních jedinců nebo jejich příbuzných. Klinicky nejčastější vylučované příčiny jsou arteriální hypertenze, aortální stenóza nebo sportovní srdce. Že se každý specialista může na HCM dívat trochu jinak, ukazuje práce londýnských autorů (Captur et al., J Am Coll Cardiol Img 2021). „V zásadě, když rozdáte expertům z center párované datasety magnetické rezonance nebo echokardiografie, tak vidíte, jak se mezi sebou významně liší ve variabilitě měření maximální tloušťky levé komory, která je zásadní nejen k samotné diagnostice HCM, ale má také implikace pro rizikovou stratifikaci, a platí to jak pro magnetickou rezonanci, tak pro echokardiografii,“ konstatoval doc. Bonaventura a dodal, že problém může být v samotné interpretaci snímku, ale také v samotné definici HCM, která se řídí maximální tloušťkou stěny (MWT) 15 mm a více. Britská práce pracující s početnou populační kohortou ukázala (Shiwani et al., J Am Coll Cardiol 2025), že MWT může poměrně významně variovat v závislosti na věku, pohlaví a povrchu těla a dokáže pravděpodobně diagnózu HCM značným způsobem zpřesnit.
Doc. Bonaventura dále upozornil na úskalí stanovení diagnózy HCM, které leží už v samotné definici. Definice HCM je zavedena již několik dekád – hypertrofie stěn bez vysvětlující hemodynamické příčiny a tloušťka stěny 15 mm, resp. 13 mm u geneticky pozitivních jedinců nebo jejich příbuzných. Klinicky nejčastější vylučované příčiny jsou arteriální hypertenze, aortální stenóza nebo sportovní srdce. Že se každý specialista může na HCM dívat trochu jinak, ukazuje práce londýnských autorů (Captur et al., J Am Coll Cardiol Img 2021). „V zásadě, když rozdáte expertům z center párované datasety magnetické rezonance nebo echokardiografie, tak vidíte, jak se mezi sebou významně liší ve variabilitě měření maximální tloušťky levé komory, která je zásadní nejen k samotné diagnostice HCM, ale má také implikace pro rizikovou stratifikaci, a platí to jak pro magnetickou rezonanci, tak pro echokardiografii,“ konstatoval doc. Bonaventura a dodal, že problém může být v samotné interpretaci snímku, ale také v samotné definici HCM, která se řídí maximální tloušťkou stěny (MWT) 15 mm a více. Britská práce pracující s početnou populační kohortou ukázala (Shiwani et al., J Am Coll Cardiol 2025), že MWT může poměrně významně variovat v závislosti na věku, pohlaví a povrchu těla a dokáže pravděpodobně diagnózu HCM značným způsobem zpřesnit.
Další nejistota spočívá v údajích o prevalenci HCM. „Upřímně řečeno, nemáme přesná data, jak je HCM častá,“ připustil doc. Bonaventura. Podle různých studií to může být 1 : 500, ale i 1 : 200 – Husser et al. (PLoS ONE 2018) započítávají genotyp pozitivní jedince, jedince, u kterých je diagnóza minuta na echokardiografii a je stanovena až pomocí MR, nebo zahrnují i dosud nevyšetřené prvostupňové příbuzné. „To by znamenalo, že se po naší zemi pohybují pravděpodobně nižší desítky tisíc pacientů, z nichž značná část je nediagnostikována, protože nemají symptomy. A ta druhá, větší část má symptomy, které známe, ale z jiných diagnóz, a nejsou úplně specifické pro HCM,“ vyvodil doc. Bonaventura. Podle něj je v případě symptomů vždy nutné věnovat pozornost synkopám. Nevysvětlená synkopa je izolovaným nezávislým rizikovým faktorem náhlé smrti a vždycky si zaslouží podrobné dovyšetření v diagnostickém procesu, který z velké části pobíhá mimo centra pro HCM. „Mimo centra se nejprve zaměřujeme na metody, které jsou rychlé, levné a dostupné, tedy odběr osobní a rodinné anamnézy, fyzikální vyšetření, EKG, které je z více než 90 procent u pacientů s HCM patologické,“ vyjmenoval doc. Bonaventura a doplnil transthorakální echokardiografii (tloušťka stěny LK, hypertrofické papilární svaly, pozice a počet papilárních svalů, prodloužený přední cíp mitrální chlopně, obstrukce LVOT i midventrikulárně) a Holter EKG, při kterém by se nemělo pátrat jen po komorových arytmiích, které jsou frekventní, ale také po fibrilaci síní, která je jednou z nejčastějších komplikací HCM. K „problémům“ echokardiografie doplnil, že viditelné ztluštění stěn nemusí znamenat jen hypertrofii kardiomyocytů, ale může signalizovat i některé vzácnější diagnózy jako amyloidózy nebo metabolická onemocnění včetně Fabryho choroby – jejich časná diagnostika je naprosto zásadní v souvislosti s dostupnou léčbou, při níž se pacientům daří tím lépe, čím dříve je léčba nasazena.
„Když se na vertikální ose přesuneme do center, zjistíme, že tady do diagnostického procesu mnoho nepřidáváme. V echokardiografickém vyšetření doplňujeme občas jícnovou echokardiografii před indikací SRT a pro hodnocení mitrální patologie, doplňujeme expertní magnetickou rezonanci k odlišení fenokopií a popsání aneurysmat hrotu, doplňujeme diagnostiku amyloidóz DPD scanem u symptomatických pacientů s bolestmi na hrudi a dušností. Podle kardiovaskulárních rizik indikujeme vyšetření koronárních tepen, ať už CT vyšetřením, nebo invazivním vyšetřením, a také před SRT mandatorně provádíme koronarografii,“ uvedl doc. Bonaventura a zdůraznil, že podstatné je, že diagnózu HCM a zpravidla i diagnózu obstrukce je možné stanovit mimo specializované centrum. „Problémem může být někdy zjistit etáž obstrukce. Někdy nám pomůže v diagnostice etážové obstrukce i transezofageální vyšetření,“ řekl doc. Bonaventura. Dále jsou symptomatičtí pacienti léčeni v regionech léky první linie, které jsou bezpečné, dostupné a levné. U řady pacientů mohou být efektivní, a pokud efektivní nejsou, mělo by léčbu převzít centrum se specifickou léčbou (mavakamten, SRT, arytmologická léčba – ablace, implantace ICD, CRT‑D). „Znovu připomínám, že v první linii léčby bychom se neměli soustředit jen na léčbu obstrukce, ale věnovat se i fibrilaci síní, která se rozvine u čtvrtiny i více pacientů s HCM. Tady je nejdůležitější při první klinické epizodě fibrilace nebo flutteru síní nasadit pacientům antikoagulační terapii v prevenci tromboembolických komplikací, a to bez ohledu na CHA2DS2‑VA skóre,“ uzavřel doc. Bonaventura.