ROZHOVOR: U trombózy (zvláště atypické) mysleme na PNH
Paroxysmální noční hemoglobinurie (PNH) představuje vzácné onemocnění, jehož podkladem je získaná klonální porucha kmenové krvetvorné buňky. V jejím…
Paroxysmální noční hemoglobinurie představuje potenciálně závažné onemocnění krvetvorby s jasnou patofyziologií vzniku.
Červinek L. Paroxysmální noční hemoglobinurie – od klinických potíží k léčbě. Remedia 2025; 35: 123–126.
Inhibitory C5 složky komplementu se staly globální první volbou léčby onemocnění. Pro pacienty s extravaskulární hemolýzou je v rámci léčby indikováno podání pegcetakoplanu. Další možností je nový blokátor alternativní dráhy komplementu iptakopan. Iptakopan prokázal v klinických studiích fáze III APPLY‑PNH a APPOINT‑PNH splnění primárních cílových ukazatelů, a to zvýšení koncentrace hemoglobinu minimálně o 20 g/l a zvýšení jeho hodnoty alespoň na 120 g/l. Bezpečnostní profil iptakopanu je příznivý.
Klíčová slova: PNH – ekulizumab – ravulizumab – pegcetakoplan – iptakopan.
Cervinek L. Paroxysmal nocturnal hemoglobinuria – from clinical manifestations to treatment. Remedia 2025; 35: 123–126.
Paroxysmal nocturnal hemoglobinuria is a potentially serious hematopoietic disease with a clear pathophysiology. C5 inhibitors of the complement have become the global first choice for the treatment of the disease. For patients with extravascular hemolysis, pegcetacoplan is indicated as a part of treatment. Another option is a new alternative complement pathway inhibitor, iptacopan. In the phase III clinical trials APPLY‑PNH and APPOINT‑PNH, iptacopan treatment was associated with achievement of the primary objectives, i.e. hemoglobin level increase by 20 g/l and above 120 g/l. The safety profile of iptacopan is favorable.
Key words: PNH – eculizumab – ravulizumab – pegcetacoplan – iptacopan.
Paroxysmální noční hemoglobinurie (PNH) je velmi vzácné získané komplexní onemocnění krvetvorby. U nemocných pacientů dochází k souběžnému postižení erytrocytů, granulocytů, monocytů i trombocytů, jelikož příčinou onemocnění je získaná mutace genu PIG A (phosphatidylinositol glycan anchor biosynthesis class A), který je lokalizován na chromozomu X. Mutace tohoto genu vede k deficienci struktur kotvených na membránu erytrocytu, které za normálních okolností chrání krvinky před jejich zánikem působením komplementu. Mezi tyto chybějící struktury řadíme regulátor proximální dráhy komplementu CD55 a regulátor terminální složky komplementu CD59. Chybění těchto složek na membráně erytrocytů i dalších krvinek je základem flowcytometrické diagnostiky pacientů s PNH. Jelikož je klinický obraz onemocnění různorodý, mohou se s pacienty s dosud nediagnostikovaným onemocněním setkat lékaři mnoha specializací.
Jako vedoucí klinický syndrom onemocnění se v praxi uplatňuje především anémie s doprovodnými klinickými příznaky, jako jsou dušnost, únava nebo nevýkonnost. Výraznou únavou je postiženo přibližně 75–89 % pacientů s PNH. S pacienty s anémií se mohou setkat lékaři mnohých interních specializací, jako jsou nefrologové, pneumologové, gastroenterologové, kardiologové, ale i praktičtí lékaři. Lékaři těchto oborů často odesílají pacienta k hematologickému vyšetření ke zjištění příčiny anémie.
Příčina anémie je často multifaktoriální, nejčastěji je důsledkem intravaskulárního rozpadu červených krvinek (hemolýzy) způsobeného aktivovaným komplementem. Další příčinou může být primární selhání kostní dřeně, do této skupiny řadíme například pacienty s aplastickou anémií a přítomností PNH klonu. Jinou příčinou anémie může být nedostatek zásobního železa při opakovaných ztrátách močí při hematurii. V neposlední řadě nacházíme pacienty s nefrogenní složkou anémie při chronické renální insuficienci. Klasickou formou anémie při PNH je hemolytická anémie s negativním přímým a nepřímým antiglobulinovým testem a vysokou koncentrací retikulocytů. Laboratorně nacházíme zvýšení hodnot bilirubinu, jaterních testů a obvykle i velmi vysokou koncentraci laktátdehydrogenázy, jež ukazuje na intravaskulární hemolýzu (IVH). Právě kombinace hemolytické anémie s negativním antiglobulinovým testem a vysokou koncentrací laktátdehydrogenázy může být prvním vodítkem k vyšetření pacienta stran PNH. Zásoba železa může být u pacientů snížena při opakovaných ztrátách do moči při atakách hemoglobinurie, normální nebo i zvýšená koncentrace železa se objevuje, pokud je pacient závislý na podávání krevních transfuzí.
Další pacienti mohou mít iniciální příznak nemoci závažnější – bývá to často nečekaná trombóza v arteriálním či venózním řečišti, nezřídka v oblasti jaterních či slezinných žil, v mozkových splavech, tj. v klinicky atypických lokalizacích trombózy.
Zhruba 29–44 % pacientů s PNH prodělá více než jednu trombózu v průběhu života. Příčinou trombotických komplikací je aktivace systému IVH. Riziko trombózy je u těchto nemocných výrazně zvýšeno a není zcela odstraněno ani účinnou antikoagulační léčbou, pokud není stabilizováno základní onemocnění. V minulosti před zavedením léčby inhibitory komplementu byly trombotické komplikace signifikantní příčinou mortality a morbidity pacientů s PNH. Pokud je u pacienta zjištěna trombotická komplikace v kombinaci s korpuskulární hemolytickou anémií, je namístě zvážit testování nemocného stran PNH klonu.
Další klinické problémy u pacientů s PNH mohou zahrnovat polykací potíže v oblasti jícnu při poruše motility a křečích jícnu, a dále dušnost při chronické plicní hypertenzi, jež často vede k odeslání pacienta na kardiologické či pneumologické vyšetření. Další skupina pacientů je zachycena v rámci došetření příčiny nefropatie až chronického selhání ledvin. V rámci ataky hemolýzy s ikterem mohou být pacienti odesláni na vyšetření na infekční oddělení k vyloučení akutní hepatitidy, stejně jako část pacientů je vyšetřována na chirurgii s podezřením na akutní onemocnění žlučníku. V neposlední řadě je nutno část pacientů hledat rovněž na urologickém pracovišti, kde je vyšetřována hemoglobinurie, jež může být zaměněna za erytrocyturii. U části nemocných mužů nacházíme také erektilní dysfunkci.
Je tedy zřejmé, že s pacienty s PNH se primárně může setkat i lékař jiných specializací než pouze hematolog či internista. V rámci České republiky je dostupná síť pracovišť průtokové cytometrie, a pokud lékař indikuje vyšetření periferní krve na přítomnost PNH klonu, může být diagnóza PNH potvrzena či vyvrácena během několika hodin. Starší testy spočívající v aktivaci komplementu pomocí změny pH jsou již obsoletní.
Pokud je u pacienta zachycen klon PNH krvinek, je doporučeno konzultovat jej v hematologických centrech, jelikož je potřeba komplexní zhodnocení rizik pacienta a navržení optimální léčby.
Historická podpůrná léčba onemocnění spočívá v dodávání transfuzí deleukotizované erymasy a v prevenci trombotických komplikací podáváním látek redukujících srážení krve na bázi antagonistů vitaminu K (kumarinů).
Nemocní s opakovaným masivním rozpadem červených krvinek, tj. s výraznou závislostí na podávání transfuzí, jsou ohroženi několika riziky. Opakované transfuze vedou často k přetížení organismu železem s rizikem jeho ukládání do svaloviny srdce a do jater. Dalším rizikem je rozvoj alogenních protilátek s následnými komplikacemi po transfuzích.
Pacienti s aplastickou anémií a s PNH klonem, u nichž převažuje postižení kmenové buňky, jsou léčeni v rámci specializovaných hematologických center podáním velmi silné imunosuprese či jsou směrováni k provedení transplantace krvetvorných buněk.
V posledním desetiletí se v oblasti léčby PNH objevily monoklonální protilátky, které zcela změnily léčbu onemocnění. Léčba inhibitory komplementu výrazně snížila trombotické riziko nemoci a zmírnila klinické potíže pacientů.
Historicky prvním přípravkem schváleným pro léčbu pacientů s PNH byl ekulizumab. Ekulizumab je monoklonální protilátka, jejíž účinek je cílen na zastavení rozpadu krvinek cestou blokády C5 složky komplementu. Léčba pacientů spočívá v pravidelném 14denním parenterálním podávání 900 mg ekulizumabu. Před podáním léčby je povinnost všechny pacienty vakcinovat proti meningokokové infekci.
Před několika lety se do klinické praxe dostala i druhá generace inhibitorů komplementu, a to ravulizumab. Ravulizumab je upravený inhibitor komplementu, který poskytuje rychlou, kompletní a setrvalou inhibici C5 složky komplementu. Tato upravená molekula umožňuje parenterální podání s intervalem osm týdnů a je vhodná pro stabilní pacienty bez výrazné průlomové nebo extravaskulární hemolýzy (EVH).
Cílem efektivní léčby PNH je kontrola IVH a vymizení klinických potíží pacienta. Nyní dostupné inhibitory C5 složky komplementu ekulizumab a ravulizumab prodloužily přežití pacientů s PNH a zmírnily jejich projevy kontrolou IVH, což se odráží v koncentraci laktátdehydrogenázy. I přes velmi účinnou léčbu inhibitory C5 složky komplementu přibližně 82 % pacientů nedosahuje normalizace hodnoty hemoglobinu. Z těchto pacientů má 10–29 % reziduální IVH a 25–50 % EVH. Příčinou tohoto stavu může být zvýšení aktivity EVH na podkladě akumulace C3b složky komplementu a následně C3 mediovaná opsonizace erytrocytů, jež ústí v extravaskulární fagocytózu. V léčbě těchto pacientů se nyní uplatňují blokátory alternativní dráhy komplementu, jako je například pegcetakoplan [1].
Přípravek pegcetakoplan získal jako první inhibitor alternativní dráhy komplementu schválení ke klinickému užití. Pegcetakoplan je symetrická cyklická molekula tvořená dvěma identickými pentadekapeptidy, které jsou kovalentně vázány na polyetylenglykol. Látka se s vysokou afinitou váže na C3 složku komplementu (a její aktivační fragment C3b), čímž inhibuje štěpení C3 na C3a a C3b a aktivaci dalších částí komplementové kaskády. Tím reguluje jak IVH (zprostředkovanou membránu atakujícím komplexem), tak rovněž EVH (zprostředkovanou C3).
S pegcetacoplanem byly publikovány dvě multicentrické, randomizované otevřené studie fáze III PEGASUS a PRINCE [2,3]. V České republice je pegcetakoplan v současné době indikován k léčbě dospělých pacientů s PNH, kteří mají anémii. Přípravek se podává v dávce 1 080 mg 2× týdně (1. a 4. den každého týdne léčby) formou subkutánní infuze aplikované systémem infuzní pumpy (určeným pro podávání dávek do 20 ml). U nemocných s hodnotou laktátdehydrogenázy (LDH) vyšší než dvojnásobek horní hranice normy lze dávkování pegcetakoplanu navýšit na 1 080 mg každý třetí den (např. 1. den, 4. den, 7. den, 10. den, 13. den atd.), v takovém případě je třeba sledovat hodnoty LDH dvakrát týdně nejméně po dobu čtyř týdnů. U pacientů přecházejících z inhibitoru C5 na pegcetakoplan se po dobu prvních čtyř týdnů podávají oba léky zároveň tak, aby bylo riziko hemolýzy při náhlém vysazení inhibitoru C5 co nejnižší [4]. Vzhledem ke svému mechanismu účinku může pegcetakoplan zvyšovat riziko závažných infekcí způsobených opouzdřenými bakteriemi, jako jsou Neisseria meningitidis, Streptococcus pneumoniae či Haemophilus influenzae. Alespoň dva týdny před zahájením léčby pegcetakoplanem proto musejí pacienti podstoupit vakcinaci proti opouzdřeným bakteriím.
 Iptakopan
IptakopanV posledních letech bylo v rámci klinických studií intenzivně zkoumáno několik perorálních molekul inhibujících alternativní dráhu komplementu. Jedná se o inhibitor faktoru B iptakopan a inhibitor faktoru D danikopan [5].
Iptakopan je perorální selektivní inhibitor faktoru B. Faktor B je klíčovou serinovou proteázou v alternativní cestě komplementového systému. Zásadní poznatky ohledně účinnosti iptakopanu u pacientů s PNH přinesly klinické studie fáze III - APPOINT‑PNH a APPLY‑PNH [6,7].
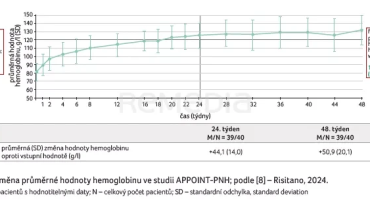
Klinická studie fáze III APPOINT‑PNH byla zaměřena na pacienty s PNH s hemolýzou a anémií, kteří dosud nebyli léčeni inhibitory komplementu. Primárním cílovým ukazatelem studie bylo dosažení hematologické odpovědi definované jako zvýšení hodnoty hemoglobinu minimálně o 20 g/l oproti výchozímu stavu bez nutnosti podávání transfuzí. Sekundárními cílovými ukazateli pak byly bezpečnost, průlomová hemolýza a transfuzní nezávislost. Studie byla koncipována jako 24týdenní léčba s následnou 24týdenní extenzí a s bezpečnostním sledováním. V rámci klinického sledování bylo dosaženo primárního cílového ukazatele – zvýšení hodnoty hemoglobinu o 20 g/l – u 31 z 33 pacientů (92 %). Ve 48. týdnu hodnocení byla průměrná hodnota hemoglobinu 132,4 g/l (graf 1) [8].
Sesterskou klinickou studií fáze III zaměřenou na pacienty s PNH léčené inhibitory C5, kteří však vykazují perzistentní anémii, byla APPLY‑PNH. Primárním cílovým ukazatelem studie bylo zvýšení koncentrace hemoglobinu minimálně o 20 g/l oproti výchozímu stavu bez podání transfuzí a zvýšení hodnoty hemoglobinu minimálně na 120 g/l. Ve 48. týdnu hodnocení byla průměrná hodnota hemoglobinu v rameni s iptakopanem 122 g/l (graf 2) [6].
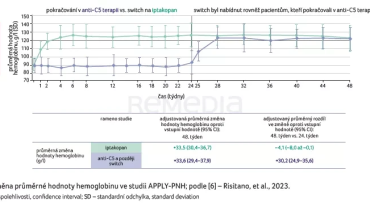 V rámci sekundárních cílových ukazatelů byly zkoumány bezpečnost, průlomová hemolýza a transfuzní nezávislost. V klinickém sledování bylo dosaženo primárního cíle superiority iptakopanu v obou primárních parametrech oproti inhibitoru C5 složky komplementu. Primárního cílového ukazatele – vzestupu hodnoty hemoglobinu o 20 g/l – bylo dosaženo u 51 z 60 pacientů, tj. u 82,3 %, ve srovnání se 2 % pacientů léčených inhibitorem C5 složky komplementu; zvýšení hodnoty hemoglobinu na 120 g/l bylo dosaženo u 42 z 60 pacientů [6,7].
V rámci sekundárních cílových ukazatelů byly zkoumány bezpečnost, průlomová hemolýza a transfuzní nezávislost. V klinickém sledování bylo dosaženo primárního cíle superiority iptakopanu v obou primárních parametrech oproti inhibitoru C5 složky komplementu. Primárního cílového ukazatele – vzestupu hodnoty hemoglobinu o 20 g/l – bylo dosaženo u 51 z 60 pacientů, tj. u 82,3 %, ve srovnání se 2 % pacientů léčených inhibitorem C5 složky komplementu; zvýšení hodnoty hemoglobinu na 120 g/l bylo dosaženo u 42 z 60 pacientů [6,7].
Dva pacienti ve studii APPLY‑PNH měli klinicky vyjádřenou průlomovou hemolýzu, naproti tomu u pacientů léčených inhibitorem C5 složky komplementu to bylo šest nemocných (graf 3A, B) [6,7]. Ve studii APPOINT‑PNH nebyla průlomová hemolýza zachycena.
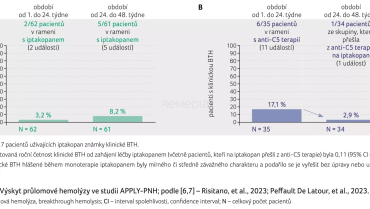 Ve studii APPLY‑PNH bylo hlášeno šest závažných nežádoucích příhod bez závažné hemolýzy, obdobně čtyři závažné nežádoucí příhody ve studii APPOINT‑PNH. Jedna vaskulární příhoda, a to tranzitorní ischemická ataka, byla hlášena ve studii APPLY‑PNH. Nejčastějšími nežádoucími účinky byly bolest hlavy (16 %), průjem (15 %) a infekce horních cest dýchacích (11 %). Bezpečnostní profil monoterapie iptakopanem po 48 týdnech byl konzistentní s údaji po 24 týdnech. Celkový bezpečnostní profil iptakopanu se jeví jako příznivý [6,7].
Ve studii APPLY‑PNH bylo hlášeno šest závažných nežádoucích příhod bez závažné hemolýzy, obdobně čtyři závažné nežádoucí příhody ve studii APPOINT‑PNH. Jedna vaskulární příhoda, a to tranzitorní ischemická ataka, byla hlášena ve studii APPLY‑PNH. Nejčastějšími nežádoucími účinky byly bolest hlavy (16 %), průjem (15 %) a infekce horních cest dýchacích (11 %). Bezpečnostní profil monoterapie iptakopanem po 48 týdnech byl konzistentní s údaji po 24 týdnech. Celkový bezpečnostní profil iptakopanu se jeví jako příznivý [6,7].
Paroxysmální noční hemoglobinurie, jako příklad vzácného, ale potenciálně velmi nebezpečného onemocnění, dokumentuje výrazný medicínský pokrok v léčbě. Klinická symptomatologie onemocnění je různorodá a pacient může být diagnostikován v rámci došetření anémie, trombózy, dušnosti, hemoglobinurie, ikteru či polykacích problémů. Diagnostickým testem na paroxysmální noční hemoglobinurii je tč. vyšetření periferní krve na přítomnost klonálních krvinek. Prvotní substitučně symptomatický postup byl nahrazen cílenou léčbou monoklonálními protilátkami blokujícími C5 složku komplementu. Další pokrok vedl k účinné blokádě alternativní dráhy komplementu pegcetakoplanem. Nyní prezentovaná malá perorální molekula iptakopanu jako blokátoru alternativní dráhy komplementu přináší další možnost účinné perorální léčby pacientů s paroxysmální noční hemoglobinurií.
MUDr. Libor Červinek, Ph.D.
Interní hematologická a onkologická klinika
FN Brno Jihlavská 20, 625 00 Brno
e‑mail: cervinek.libor@fnbrno.cz
[1] Bhak RH, Mody‑Patel N, Baver SB, et al. Comparative effectiveness of pegcetacoplan versus ravulizumab in patients with paroxysmal nocturnal hemoglobinuria previously treated with eculizumab: a matching‑adjusted indirect comparison. Curr Med Res Opin 2021; 37: 1913–1923.
[2] Peffault De Latour R, Szer J, Weitz IC, et al. Pegcetacoplan versus eculizumab in patients with paroxysmal nocturnal haemoglobinuria (PEGASUS): 48‑week follow‑up of a randomised, open‑label, phase 3, active‑comparator, controlled trial. Lancet Haematol 2022; 9: e648–e659.
[3] Peffault De Latour R, Szer J, Weitz I, et al. Forty‑eight week efficacy and safety of pegcetacoplan in adult patients with paroxysmal nocturnal hemoglobinuria and suboptimal response to prior eculizumab treatment. HemaSphere 2021; 5: 42–43.
[4] Hillmen P, Szer J, Weitz I, et al. Pegcetacoplan versus eculizumab in paroxysmal nocturnal hemoglobinuria. N Engl J Med 2021; 384: 1028–1037.
[5] Schubart A. Low‑molecular weight inhibitors of the alternative complement pathway. Immunol Rev 2023; 313: 339–357.
[6] Risitano AM, Kulasekararaj A, Roeth A, et al. Factor B inhibition with Oral Iptacopan Monotherapy Demostrates Sustained Long‑Term Efficacy and Safety in anti‑C5‑Treated Patients with Paroxysmal Nocturnal Hemoglobinuria and Persistent Anemia: Final 48‑Week Results from Multicenter, Phase III APPLY‑PNH Trial. Blood 2023; 142(Suppl 1): 571.
[7] Peffault De Latour R, Kulasekararaj A, Scheinberg P, et al. Clinical Breakthrough Hemolysis (BTH) during Monotherapy with Oral Factor B Inhibitor Iptacopan Is Generally Not Severe and Managed without Treatment Discontinuation: 48‑Week Data from the Phase III APPLY‑PNH and APPOINT‑PNH Trials in Paroxysmal Nocturnal Hemoglobinuria (PNH). Blood 2023; 142(Suppl 1): 1338.
[8] Risitano AM. Oral Iptacopan Monotherapy Maintains Efficacy and Safety over 48 Weeks in Complement Inhibitor‑Naïve Patients with Paroxysmal Nocturnal Hemoglobinuria (PNH) in the Phase III APPOINT‑PNH Trial. 50th Annual Meeting of EBMT, 14–17 April 2024, Glasgow, UK. Abstract A133.
Tisková publikace Remedia ročník 35 číslo 1/2025 str 187
Paroxysmální noční hemoglobinurie (PNH) představuje vzácné onemocnění, jehož podkladem je získaná klonální porucha kmenové krvetvorné buňky. V jejím…
Podle MUDr. Jaromíra Gumulce z FN Ostrava může paroxysmální noční hemoglobinurie dlouho probíhat bez příznaků a projevit se až atypickou či život…
Včasná diagnostika PNH a rychlé předání do centra rozhodují o osudu pacienta
PNH vyžaduje víc než antikoagulaci – cílená léčba komplementu snižuje riziko trombóz