Novinky v podání zahraničních hostů jubilejních 20. Jedličkových neuroimunologických a likvorologických dnů

Jubilejní 20. Jedličkovy neuroimunologické a likvorologické dny se konaly koncem května 2022 v pražském hotelu Pyramida. Byly věnovány především průlomovým novinkám v oblasti diagnostiky a léčby roztroušené sklerózy. O nich hovořili i dva zahraniční hosté: profesorka Mar Tintoré (Barcelona, Španělsko) a profesor Ludwiga Kappose (Basilej, Švýcarsko). Pro čtenáře zpravodaje přinášíme velmi stručný obsah jejich sdělení.
Léčba roztroušené sklerózy – co je nového?
(Disease modifying drugs – what is new?)
Mar Tintore, MD, PhD., Cemcat Vall d´Hebron Unicersity Hospital Barcelona, Španělsko
S příchodem prvních léčebných možností v devadesátých letech dvacátého století se prognóza pacientů s roztroušenou sklerózou (RS) dramaticky změnila, uvedla prof. Tintoré. Do klinických výsledků léčby se však promítají také postupně se měnící diagnostická kritéria od původních Poserových až po nejnovější McDonaldova kritéria z roku 2017, která umožní časnější stanovení diagnózy, a tím pádem i časné zahájení léčby. O tom zcela jasně vypovídá porovnání výsledků studií mezi lety 1994–2017, kdy došlo ke zkrácení času od první ataky (CIS) k diagnóze definitivní RS o 68 % a k 84% zkrácení doby od CIS k zahájení léčby. Pacienti v době dostupné léčby a nových diagnostických kritérií mají významně nižší riziko progrese k EDSS ≥ 3 než dříve. Tyto výsledky vycházejí ze závěrů retrospektivní studie založené na datech z kohorty Barcelona-CIS z let 1994 až 2020. Časně léčená skupina vykazovala aHR 0,53 (0,33–0,85), tedy 46% redukci rizika dosažení EDSS ≥ 3,0 ve srovnání s pacienty s pozdní léčbou ve stejném věku. [1]
Analýza dat z velké mezinárodní databáze Big Multiple Sclerosis Data Network (BMSD) koordinačního centra Karolinska Institutet prokázala v mediánu sledování 13,3 roku významně snížené riziko progrese disability, začne-li léčba do 1,2 roku od začátku onemocnění. [2]
V současnosti probíhá několik klinických studií o tom, zda, respektive kterou léčbou lze ve stadiu RIS (radiologicky izolovaný syndrom) předejít rozvoji definitivní RS. Výsledky v současnosti nejsou známy, uvedla profesorka Mar Tintoré. [3]
Těhotenství
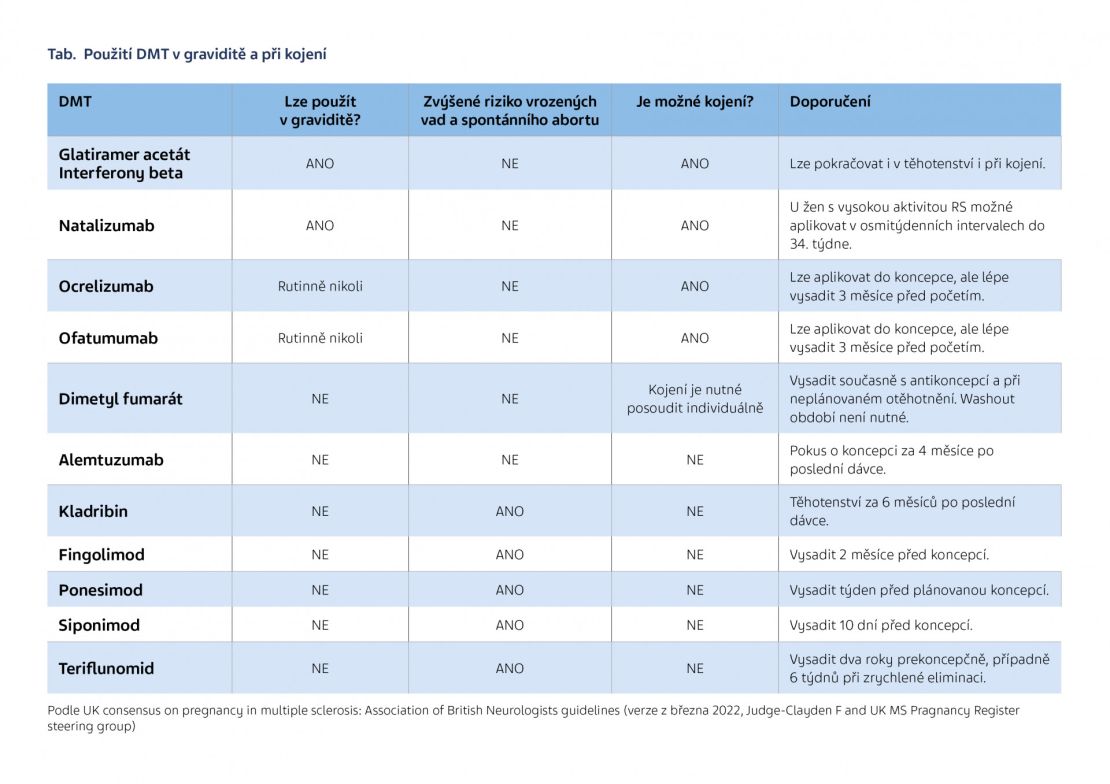
„Léčba nemá být kvůli plánovanému budoucímu těhotenství odkládána,“ zdůraznila profesorka Tintoré. Podle dat z MSBase v letech 2005–2016 bylo zaznamenáno 1 521 těhotenství u 1 178 žen, které byly léčeny DMT. V roce 2006 bylo 27 % těhotenství exponováno DMT (většinou šlo o glatiramer acetát a interferony), zatímco v roce 2016 už podíl DMT exponovaných gravidit činil 62 %. Nebyly pozorovány žádné nežádoucí účinky a negativní ovlivnění gravidity, ani plodu.
Neurologové by měli mít na paměti možné těhotenství už při volbě DMT u mladých žen. U pacientek s vysokou aktivitou RS je vhodné uvažovat o léčbě během gravidity kvůli riziku rebound fenoménu po vysazení DMT. Po porodu je u žen s vysokou aktivitou onemocnění žádoucí se co nejdříve vrátit k původní léčbě, doporučila profesorka Tintoré. Základní doporučení u jednotlivých DMT ohledně gravidity a kojení jsou uvedena v tabulce.
Nové léky pro RR-RS
Profesorka Mar Tintoré se věnovala nově schválenám lékům, a to včetně výsledků jejich registračních studií. Jmenovala ozanimod (Zeposia, inhibitor S1P1 a S1PS receptorů), ponesimod (Ponvory, modulátor receptorů S1P1), ofatumumab (Kesimpta, monoklonální protilátka s anti-CD20 působením) a ublituximab (monoklonální protilátka s anti-CD20 působením, která zatím nemá registraci ani v USA, ani v EU).
Progresivní RS
Pro progresivní RS jsou v současnosti registrovány:
Ocrelizumab (Ocrevus) pro primárně progresivní RS (PP-RS) byl schválen FDA v březnu 2017 a EMA v lednu 2018. V současnosti jsou již dostupná i sedmiletá data z otevřené extenze studie (OLE), která byla prezentována na kongresu Americké neurologické asociace (74. AAN, duben 2022). Nárůst 48týdenní opakovaně ověřované CDP (confirmed disability progression) podle EDSS a kompozitní CDP byl významně nižší (o 24 % a 25 %) u těch, kteří zahájili léčbu ocrelizumabem dříve v porovnání se skupinou s odloženou léčbou. Během sedmi let byl nárůst 48týdenní opakované CDP-9HPT a CDP-T25FW významně nižší (o 36 % a 27 %) u těch, kteří zahájili léčbu ocrelizumabem dříve v porovnání s léčbou odloženou. [7]
Siponimod (Mayzent) vysoce selektivní agonista pro receptory S1P1a S1P5 je první léčivý přípravek schválený pro sekundárně progresivní RS. FDA jej schválila v březnu 2019, EMA v lednu 2020. Ve studii EXPAND prokázal siponimod superioritu oproti placebu: 21% redukci CDPa 15% redukci mozkové atrofie.
Pacienti s neaktivní SP-RS
Zůstává otázka, jak přistupovat k pacientům s neaktivní SP-RS, kteří vykazují mírně horší klinické léčebné výsledky než pacienti s aktivní SP-RS. Příkladem je studie EXPAND se siponimodem, kdy v celkové studijní populaci došlo za 42 týdnů u 21 % léčených k redukci tříměsíční CDP (oproti placebu), ale u 31 % pacientů s aktivní SP-RS (vs. placebo). Profesorka Tintoré upozornila, že průběh je nutné monitorovat, protože fenotyp RS se může v čase měnit.
Otázka – léčit, či neléčit SP-RS bývá nazývána i Zlatým grálem neurologie. Podle profesora Gavin Giovannoniho (ECTRIMS 2001) se v reálných i klinických studiích aktivita na MRI zdá být citlivějším měřítkem aktivity onemocnění v porovnání s relapsy. V reálném světě však může představovat monitorování MRI u neléčených pacientů s „neaktivní“ SP-RS problém, který snižuje šanci na detekci a léčbu jakékoli nové aktivity onemocnění. [8] Profesorka Tintoré k tomu uvedla, že příčinou „tiché“ progrese mohou být pomalu rostoucí léze.
S cílem ovlivnit zánět v CNS
Pomalu se zvětšující léze jsou do jisté míry ovlivněny dlouhodobým zánětem, který je přítomen od počátku RS až do pokročilých fází, i když s postupujícím časem převládá neurodegenerace, která je však též závislá na zánětu. Jak uvedla profesorka Tintoré, v této oblasti se zdají být přípravky na principu inhibice Brutonovy tyrozinkinázy (BTKI) velmi nadějné. Brutonova tyrosinkináza (BTK) reguluje funkce B lymfocytů a myeloidních buněk, které se podílejí na patogenezi roztroušené sklerózy. Evobrutinib je selektivní perorální inhibitor BTK, u kterého bylo prokázáno, že inhibuje aktivaci B-buněk in vitro i in vivo. Výsledky klinické studie fáze II s perorálním evobrutinibem naznačují, že by evobrutinib mohl ovlivňovat mikroglie a makrofágy v CNS. [9]
V současnosti probíhají klinické studie s tolebrutinibem, dalším BTKI (GEMINI a PERSEUS).
Proti neurodegeneraci
Masitinib je inhibitor tyrozinkináz, který ovlivňuje mastocyty a mikroglie. Předběžné výsledky klinické studie naznačují, že léčba masitinibem může vést k redukci progrese EDSS a tříměsíční CDP. [10]
Historicky se zkoušely u progresivních forem i simvastatin, ibudilast či kyselina lipoová, jejichž předběžné výsledky v ovlivnění rychlosti atrofie mozku jsou slibné, ale je nutné ověřit je dalšími velkými klinickými studiemi. Ve stadiu ověřování je protokol transplantace autologních mesenchymálních buněk z kostní dřeně.
Ageing population
Stárne populace světová i populace pacientů s RS, nemocní se dožívají díky léčbě vyššího věku, dožijí se i komorbidit. Jak věk a senescence imunitního systému, tak komorbidity mají vliv na účinnost a bezpečnost DMT. „Do klinických studií jsou v převážné většině zařazování lidé do 50, maximálně do 55 let. Přitom jsou naši pacienti i starší než 65 let a my nevíme, jak podané léky fungují, “ řekla profesorka Tintoré. Proto je nutné uspořádat studie, které by ověřili účinnost, a především bezpečnost DMT u seniorské populace. Profesorka Tintoré vyzdvihla význam reálných dat z registrů, která mohou upozornit na rizika nežádoucích účinků, včetně onkologických onemocnění spojených s imunosupresivní léčbou.
COVID-19 u pacientů s RS
Výsledky analýzy kohorty 5 543 pacientů (909 s podezřením na onemocnění a 4 634 s prokázaným onemocněním COVID-19) potvrdily předchozí rizikové faktory horšího průběhu a klinických výsledků infekce SARS-CoV-2 u pacientů s RS: mužské pohlaví, vyšší věk, progresivní RS a vyšší disabilita byly spojeny s horšími klinickými výsledky. Léčba anti-CD20 DMT (ocrelizumabem a rituximabem) byla spojena s horším průběhem a výsledky ve srovnání s glatiramer acetátem: zvýšené riziko hospitalizace (aOR=1,61; 95% CI = 1,06-2,43; resp. aOR = 2,42; 95% CI = 1,54-3,81) a přijetí na JIP (aOR =3,13; 95% CI = 1,22-8,00; resp. aOR = 4,46; 95% CI = 1,64-12,09). Rituximab byl spojen se zvýšeným rizikem umělé ventilace (aOR=3,57;95% CI = 1,38-9,20); ocrelizumab vykazoval nižší riziko umělé ventilace než rituximab (aOR = 1,86; 95% CI = 0,76-4,55). Rituximab vykázal zvýšené riziko úmrtí (aOR = 2,74; 95% CI = 0,68-11,09). Tato zjištění se vztahovala pouze na potvrzené případy COVID-19. [11]
Postvakcinační protilátková a buněčná odpověď: studie SAR-EM
Do studie bylo zařazeno 457 pacientů. Pozorování ukázala, že humorální odpověď se snížila při léčbě modulátory sfingosin-1-fosfátového receptoru (S1PRM) a při léčbě anti-CD20 přípravky, s delším trváním léčby. Odpověď se zvýšila po 4,5 měsících od poslední infuze anti-CD20. Buněčná odpověď byla nižší u pacientů léčených S1PRM. U pacientů na léčbě anti-CD20 přípravky může být zachována buněčná odpověď i bez přítomnosti humorální odpovědi (91,4 %). [12]
Doporučení ECTRIMS pro vakcinaci pacientů
Základní pravidla:
- Ověření stavu imunitního systému bez ohledu na terapeutický plán.
- Informace pacienta o významu vakcinace a riziku u neočkovaných pacientů; názory a priority pacienta by měly být respektovány.
- Vakcinace by měla proběhnout v čase diagnózy nebo v co nejčasnějších stadiích onemocnění, aby se předešlo odkladu zahájení léčby DMT.
Vakcinace před podáním imunosuprese
- V souladu s regionálními standardy a riziky vyplývajícími z léčby.
- Inaktivované vakcíny lze podat kdykoli, optimálně 2–3 týdny před podáním imunosuprese.
- Živé (oslabené) vakcíny se smějí aplikovat minimálně 4 týdny před imunosupresí.
Imunosupresivní DMT: DMF, teriflunomid, modulátory S1P, natalizumab, cladribin, alemtuzumab a anti-CD20 přípravky.
Bezpečnost očkování
- Izraelská skupina udává, že relaps zaznamenalo po první dávce vakcíny do čtyř měsíců 3,1 %, což je stejný podíl jako u neočkovaných.
- Analýza 102 pacientů plně očkovaných mRNS vakcínami vykázala u 5,9 % pseudo-relaps, ale nikoli skutečný relaps.
Význam biomarkerů (digitálních, krevních a zobrazovacích)
(Role of biomarkers (digital, blood, imaging) in reshaping clinical MS research and daily care)
Prof. Dr. Ludwig Kappos, University Hospital and University of Basel, Švýcarsko
Léčba roztroušené sklerózy (RS): fáze vývoje
Svou prezentaci uvedl profesor Kappos výletem do historie. Moderní výzkum RS se datuje od poloviny dvacátého století a koncem dvacátého století již bylo jasné, že jde o autoimunitní onemocnění. K prvním používaným lékům patřila imunosupresiva a kortikosteroidy. Dále se profesor Kappos věnoval popisu historických milníků terapie RS.
Od imunosuprese k imunomodulaci (1960–1990)
Interferony byly prvními účinnými imunomodulačními léky, které prokázaly účinnost v klinických studiích. V první studii (multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované studii) s interferonem beta-1b (IFNβ-1b) u 372 ambulantních pacientů s relaps-remitující roztroušenou sklerózou (RR-RS) IFNβ-1b prokázal svou účinnost ve snižování počtu relapsů a v počtu pacientů bez relapsu v porovnání s placebovou skupinou. Efekt byl závislý na dávce, nejvíce z léčby profitovali pacienti s nejvyšší dávkou IFNβ-1b. [13]
Zlatá éra klinických studií (1990–2020)
Jako příklad inovativního léčivého přípravku uvedl profesor Kappos ocrelizumab, jehož účinnost a bezpečnosti byla ověřována ve studiích OPERA I/II. Výsledky významně favorizují ocrelizumab vůči komparátoru. [14] Důležité však je, že efekt ocrelizumabu nemizí v řase, o čemž svědčí dlouhodobá data (v roce 2022 již sedmiletá). Ocrelizumab prokázal dlouhodobý efekt i u progresivní RS; ve studii ORATORIO byl porovnáván s placebem. Efekt přetrvával i v otevřené fázi (OLE). [15]
Dalším příkladem vysoce účinné léčby je ofatumumab, který byl zkoumán ve dvou klinických studiích s identickým designem – ASCLEPIOS I/II. [16]
Jediný léčivý přípravek schválený pro sekundární progresi (SP-RS), siponimod, taktéž vykázal dlouhodobou účinnost jak v samotné klinické studii (EXPAND), tak i v její extenzi. [17]
Nejde jen o účinnost, ale i o bezpečnost, upozornil profesor Kappos. Zejména pandemie COVID-19 nás poučila, že není radno podceňovat infekce. Z tohoto hlediska je dlouhodobé sledování všech pacientů ze studií z ocrelizumabem velmi důležité: riziko infekce velmi mírně narůstá u pacientů s PP-RS, ale u nemocných s RR-RS je v čase stabilní a nízké. [18]
Progrese nezávislá na relapsech (PIRA, Progression Independent from Relaps Activity)
Akumulace disability může nastat v souvislosti s relapsem (relapse activity whorsening, RAW) nebo bez souvislosti s relapsem (PIRA). Předchozí studie ukázaly, že PIRA je častá, vyskytuje se v časných stadiích RS, je běžná dokonce i během léčby vysoce účinnými přípravky. V souboru reálných dat u více než 27 000 pacientů s RS trvající až 15 let u nemocných s RR-RS vedla PIRA k postupující disabilitě častěji než RAW (47,3 % vs. 26,9 %). V metaanalýze klinických studiích fáze III byla PIRA častější (34,5 % vs. 32,7 %) a vedla k progresi disability u 76,7 % až 77,7 % u SP-RS a u 83,4 % PP-RS. V těchto studiích byla PIRA méně častá u pacientů na DMT (11,4 % vs. 17,3 % u RR-RS; 18,5 % vs. 22,7 % u SP-RS; 32,1 % vs. 33,9 % u PP-MS). [19]
„Nyní je k dispozici dostatek důkazů, které svědčí o tom, že progrese probíhá většinou nepozorovaně bez zjevných relapsů,“ uvedl Kappos. RS je onemocnění s trvale progresivním, ale individuálním průběhem. Tato progrese zůstává často nerozpoznána. Úbytek mozkové tkáně je do jisté míry kompenzován plasticitou nervové tkáně a kognitivní rezervou, a to činí progresi do určitého stadia klinicky těžko diagnostikovatelnou.
Biomarkery a jejich význam
Digitální biomarkery
Evropská léková agentura definovala požadavky na digitální biomarkery, které by mohly být využity i v klinických studiích:
- musejí být schopny objektivní kvantifikace fyziologických funkcí a/nebo chování, aby mohly být použity jako indikátor biologických, patologických procesů nebo odpovědi na expozici či intervenci,
- klinický význam musí být založen na skutečném vztahu digitální technologie k existujícím validovaným kritériím,
- potenciální výhody digitálních biomarkerů spočívají ve vysoké časové přesnosti, jsou získány z hlášení samotným pacientem nebo pasívní monitorací a pokrývají domény, které lze jinak obtížněji hodnotit, například únavu, kognici a jemnou motoriku,
- digitální biomarkery musejí splňovat požadavky na bezpečnost a ochranu soukromí, snadnost ovládání, technickou spolehlivost, přesnost týkající se intraindividuálních změn, obsahovou validitu a na klinický význam.
Profesor Kappos uvedl několik příkladů existujících a vyvíjejících se digitálních markerů:
MSCopilot (Francie), Floodlight (Roche), dreaMS.
Vizí do budoucnosti je sbírat data z aplikací, MRI, klinických vyšetření, které pak umělá inteligence vyhodnotí a vytvoří platformu k podpoře klinického rozhodování.
Zobrazovací metody
Doporučené postupy provedení a vyhodnocení MRI vypracovala skupina expertů MAGNIMS (Magnetic Resonance Imaging in MS). Obsahuje doporučené sekvence zobrazení mozku pro konkrétní stavy u pacientů s RS (diagnostika, monitorace, sledování bezpečnosti apod.) a doporučené intervaly mezi jednotlivými vyšetřeními MRI.
Profesor Kappos zmínil, že popis nálezu MRI vyžaduje velkou zkušenost a je časově velmi náročný. Práci radiologa pak může usnadnit automatizace vyhodnocení nálezu.
Frakce myelinové vody
Skutečné změny mozkové tkáně objasní definitivně až patolog. Existuje biomarker pro detekci různých typů lézí při vyšetření MRI (chronické aktivní léze, fokální meningeální zánětlivé změny, ztráta axonů, kortikální léze)? Je normálně vypadající mozková tkáň na MRI skutečně bez patologie? Jako biomarker axonálního poškození může sloužit myelinová voda (myelin water imaging, MWI, zobrazovací biomarker pro myelin) kvantifikovaná víceplášťovým difuzním (multi-shell diffusion) zobrazením. Nálezy naznačují, že patologie myelinu a axonů u RS je rozsáhlá jak v lézích, tak v tkáni normálního vzhledu, pacienti s P-RS se liší od pacientů s RR-RS pacientů rozsáhlejším poškozením axonů/myelinu v kůře; patologie myelinu a axonů v lézích souvisí s disabilitou. [20]
Biomarkery chronických lézí a remyelinizace
Stále přetrvává však problém identifikovat specifické typy chronických, zejména remyelinizovaných lézí in vivo u pacientů s RS. V citované studii (uveřejněné 17. června 2022. doi: 10.1002/ana.26441) autoři prokazují, že vyšetření (na tříteslové MRI): kvantitativní mapování citlivosti (QSM), myelinové vodní frakce (MWF), mapy indexu hustoty neuritů (NDI) koreluje s post mortem nálezy. [21]
U roztroušené sklerózy (RS) mohou být chronické aktivní léze identifikovány pomocí susceptibility-based MRI in vivo jako gadolinium neenhacující léze s paramagnetickými okraji (PRL). Patologicky se projevují jako smoldering léze s aktivními okraji, nedostatečná remyelinizace a axonální degenerace. Citovaná studie prokázala, že chronické aktivní léze jsou běžné, jsou spojeny s agresivnějším onemocněním, způsobují progredující poškození tkáně a vyskytují se dokonce i u jedinců léčených účinnými DMT. [22]
Chronické aktivní léze RS charakterizované hyperintenzním lemem s vysokým obsahem železa, s aktivovanými mikrogliemi a makrofágy, byly spojeny s větším poškozením tkáně. Studie post mortem zjistily, že chronické aktivní léze primárně souvisí s vyššími stádii RS; ale zdá se, že smoldering a aktivní léze jsou přítomny v raných stadiích RS. Při histopatologickém vyšetření vykazovaly chronické aktivní i smoldering léze závažnější axonální poškození na okraji léze než v centru. Chronický zánět bílé hmoty byl spojen se zvýšenými koncentracemi sNfL a větší závažností onemocnění, což naznačuje, že PRL přispívá ke klinicky relevantní neurodegeneraci, k níž dochází v důsledku zánětu. [23]
S technickým zdokonalováním přístrojů MRI (7 T) lze identifikovat kortikální léze, které mají taktéž prediktivní charakter. Vyšší počet kortikálních lézí předpovídá kratší dobu do SP-RS. Pro znázornění kortikálních lézí existují již nástroje automatické detekce. [24]
Lehké řetězce neurofilament
O tomto biomarkeru se hovoří již několik let, ale zatím si nenašel místo v rutinní praxi, protože chybějí ověřené, věku pacienta, stadiu a délce trvání RS odpovídající kritéria.
Koncentrace lehkých řetězců neurofilament (NfL) v likvoru a séru přísně korelují. Jejich zvyšující se koncentrace je spojena se současným i budoucím relapsem a progresí disability a provázejí vznik mozkových a míšních lézí a atrofie.
Leppart s kolegy zjistil, že vyšší koncentrace sérových NfL jsou spojeny s budoucí progresí disability a stupněm atrofie mozku bez ohledu na přítomnost nebo nepřítomnost současné aktivity onemocnění (gadolinium enhancující léze nebo nedávný relaps). Koncentrace sérových pNfL byly nižší u pacientů léčených siponimodem nebo fingolimodem oproti pacientům na placebu a vyšší u pacientů, u kterých došlo k progresi disability (analýza studií EXPAND a INFORMS). [25]
Bez validace referenčních hodnot koncentrace NfL však nelze toto kritérium využít jako diagnosticko-prognostický marker v klinické praxi.
Závěrem profesor Kappos upozornil, že biomarkery je nutné ověřovat ve velkých klinických studiích, aby mohly sloužit jako kritéria pro posuzování účinnosti léčby. Dlouhodobé studie musejí vycházet nejen z dat randomizovaných studií fáze II a III, ale i z dat reálné praxe.
Biomarkery jsou velmi důležité pro klinické rozhodování, a proto musejí být spolehlivé a aplikovatelné na širokou populaci pacientů s RS.
Literatura
[1] Tintore M, et al. Effect of Changes in MS Diagnostic Criteria Over 25 Years on Time to Treatment and Prognosis in Patients With Clinically Isolated Syndrome. Neurology. 2021 Sep.
[2] Iaffaldano P. Early treatment delays long-term disability accrual in RRMS: Results from the BMDS network. Mult Scler J. 2021.
[3] Tremlett H, et al. The multiple sclerosis prodrome is just unspecific symptoms in radiologically isolated syndrome patients – No. Mult Scler J. 2021(27) 12:1824-1826.
[4] Ontaneda D, et al. Determining the effectiveness of early intensive versus escalation approaches for the treatment of relapsing-remitting multiple sclerosis: The DELIVER-MS study protocol. Contemp Clin Trials. 2020 Aug;96:106009.
[5] He A, et al. Timing of high-efficacy therapy for multiple sclerosis: a retrospective observational cohort study. Lancet Neurol. 2020 Apr;19(4):307-316).
[6] Rotstein D, et al. Association of No Evidence of Disease Activity With No Long-term Disability Progression in Multople Sclerosis: A Systematic Review an Meta-Analysis, Neurology. April 26, 2022, DOI: https://doi.org/10.1212/WNL.0000000000200549.
[7] Kappos L, et al. Repeated Confirmed Disability Progressions Analyses of the OPERA and ORATORIO Studies and Their Open‑Label Extensions. Presented virtual at the 74th Annual Meeting of the American Academy of Neurology (AAN), 2022 April 24–26, 2022; Poster number P7.4‑002.
[8] Giovannoni G, et al. MRI activity versus relapses as markers of disease activity in SPMS: Data from real world and pivotal clinical studies. ECTRIMS 2021. P001.
[9] Montalban et al. Placebo-Controlled Trial of an Oral BTK Inhibitor in Multiple Sclerosis. N Engl J Med 2019;380:2406-2417.
[11] Simpson-Yap S. Results of the COVID-19 in MS global data sharing initiative validate consistent associations of anti-CD20 and other reported risk factors with severe COVID-19 outcomes. ECTRIMS 2021.
[12] Zabalza A, et al. Is humoral and cellular responses to SARS-CoV-2 vaccine modified by DMT in patients With Multiple Sclerosis and other autoimmune deseases? Mult Scler 2022 Jun;28(7):1138-1145.
[13] The IFNB Multiple Sclerosis Study Group. Interferon beta-1b is effective in relapsing-remitting multiple sclerosis. I. Clinical results of a multicenter, randomized, double-blind, placebo-controlled trial. Neurology 1993;43:655-61.
[14] Hauser S, Kappos L, et al. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. New Engl J Med. 2017 2017; 376:221-234.
[15] Wolinsky JS, et al. Long-term follow-up from the ORATORIO trial of ocrelizumab for primary progressive multiple sclerosis: a post-hoc analysis from the ongoing open-label extension of the randomised, placebo-controlled, phase 3 trial. Lancet Neurol. 2020 Dec;19(12):998-1009.
[16] Hauser SL, et al. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N ENGL J Med; 2020; 383:546–57.
[17] Kappos L, et al. ePresentation EPR2128 at EAN 2020.
[18] Hauser SL, et al. Safety of Ocrelizumab in aprtients With Relapsing and Primary Progressive Multiple Sclerosis. Neurology 2021; 96 (16):1546–1559.
[19] Lublin FD et al. How patients with multiple sclerosis acquire disability. Brain 2022 Feb 1; [e-pub]. (https://doi.org/10.1093/brain/awac016.)
[20] Rahmanzadeh R, et al. Myelin and axon pathology in multiple sclerosis assessed by myelin water and multi-shell diffusion imaging. Brain. 2021 Jul 28;144(6):1684-1696.
[21] Rahmanzadeh R, et al A new advenced MRI biomarker identifies fully remyelinated lession in MS. Annals of neurology. 17. June. 2022. https://doi.org/10.1002/ana.26441
[22] Absinta M, et al. Association of Chronic Active Multiple Sclerosis Lesions With Disability In Vivo. JAMA Neurol. 2019;76(12):1474-1483.
[23] Maggi P, et al.Chronic White Matter Inflamation and Serum Neurofilament Levels in Multpple Sclerisis. Neurology, 2021; 97 (6): e543-e553.
[24] Rosa F, et al. Multiple sclerosis cortical and WM lesion segmentation at 3T MRI: a deep learning method based on FLAIR and MP2RAGE. Neuroimage Clin; 2020 Vol 27, 102335.
[25] Leppert D, et al. Blood Neurofilament Light in Progressive Multiple Sclerosis. Post Hoc Analysis of 2 Randomizes Controlled Trials. Neurology 2022; 98 (21).