Novinky v podaní zahraničných hostí jubilejných 20. Jedličkových neuroimunologických a likvorologických dní

Jubilejné 20. Jedličkove neuroimunologické a likvorologické dni sa konali koncom mája 2022 v pražskom hoteli Pyramida. Boli venované predovšetkým prelomovým novinkám v oblasti diagnostiky a liečby sclerosis multiplex. O nich hovorili aj dvaja zahraniční hostia: profesorka Mar Tintoré (Barcelona, Španielsko) a profesor Ludwiga Kappose (Basilej, Švajčiarsko). Pre čitateľov spravodajcu prinášame veľmi stručný obsah ich prezentácií.
Liečba sclerosis multiplex – čo je nového?
(Disease modifying drugs – what is new?)
Mar Tintore, MD, PhD., Cemcat Vall d´Hebron Unicersity Hospital Barcelona, Španielsko
S príchodom prvých liečebných možností v deväťdesiatych rokoch dvadsiateho storočia sa prognóza pacientov so sclerosis multiplex (SM) dramaticky zmenila, uviedla prof. Tintoré. Do klinických výsledkov liečby sa však premietajú aj postupne sa meniace diagnostické kritériá od pôvodných Poserových až po najnovšie McDonaldove kritériá z roku 2017, ktoré umožnia včasnejšie stanovenie diagnózy, a tým pádom aj včasné zahájenie liečby. O tom celkom jasne vypovedá porovnanie výsledkov štúdií v rokoch 1994–2017, kedy došlo ku skráteniu času od prvého ataku (CIS) k diagnóze definitívnej SM o 68 % a ku 84% skráteniu času od CIS k zahájeniu liečby. Pacienti v čase dostupnej liečby a nových diagnostických kritérií majú významne nižšie riziko progresie k EDSS ≥ 3 ako predtým. Tieto výsledky vychádzajú zo záverov retrospektívnej štúdie, založenej na dátach z kohorty Barcelona-CIS z rokov 1994 až 2020. Včasne liečená skupina vykazovala aHR 0,53 (0,33–0,85), teda 46% redukciu rizika dosiahnutia EDSS ≥ 3,0 v porovnaní s pacientami s neskorou liečbou v rovnakom veku. [1]
Analýza dát z veľkej medzinárodnej databázy Big Multiple Sclerosis Data Network (BMSD) koordinačného centra Karolinska Institutet preukázala v mediáne sledovania 13,3 roku významne znížené riziko progresie disability, ak sa začne liečba do 1,2 roku od začiatku ochorenia. [2]
V súčasnosti prebieha niekoľko klinických štúdií o tom, či, respektíve ktorou liečbou sa dá v štádiu RIS (rádiologicky izolovaný syndróm) predísť rozvoju definitívnej SM. Výsledky v súčasnosti nie sú známe, uviedla profesorka Mar Tintoré. [3]
Tehotenstvo
„Liečba nemá byť kvôli plánovanému budúcemu tehotenstvu odkladaná,“ zdôraznila profesorka Tintoré. Podľa dát z MSBase v rokoch 2005–2016 sa zaznamenalo 1 521 tehotenstiev u 1 178 žien, ktoré boli liečené DMT. V roku 2006 bolo 27 % tehotenstiev exponovaných DMT (väčšinou išlo o glatiramer acetát a interferóny), zatiaľ čo v roku 2016 už podiel DMT exponovaných gravidít predstavoval 62 %. Neboli pozorované žiadne nežiaduce účinky a negatívne ovplyvnenie gravidity, ani plodu.
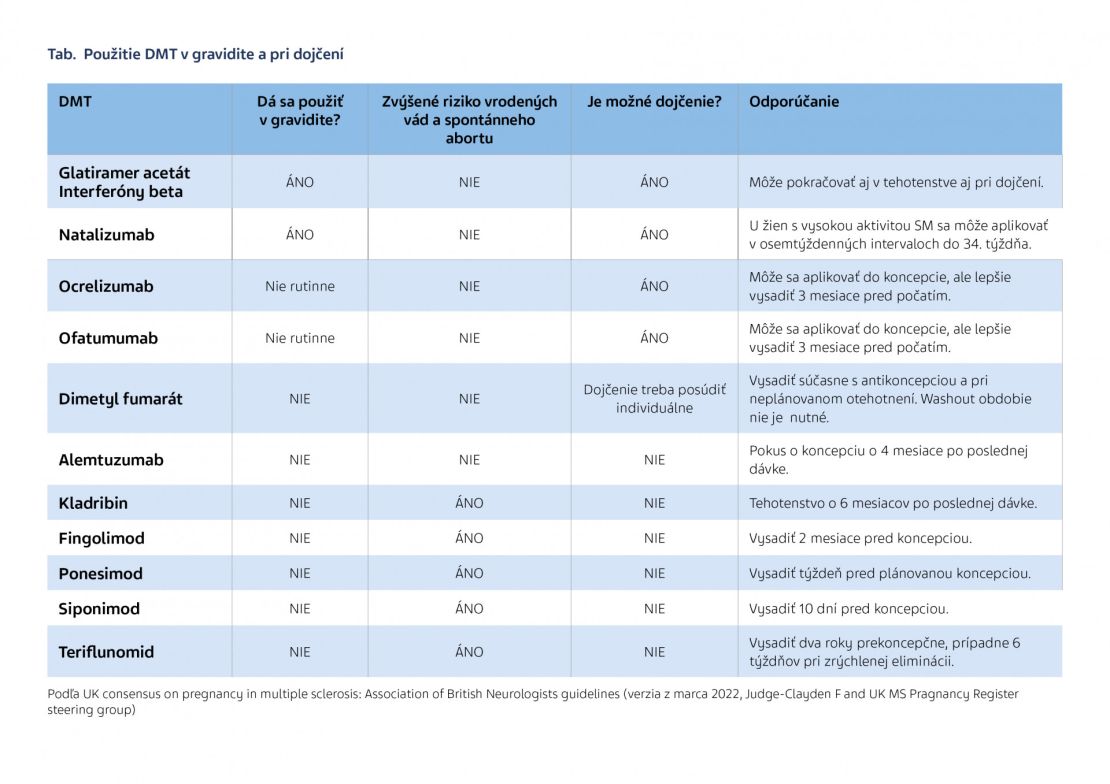
Neurológovia by mali mať na pamäti možné tehotenstvo už pri voľbe DMT u mladých žien. U pacientiek s vysokou aktivitou SM je vhodné uvažovať o liečbe počas gravidity kvôli riziku rebound fenoménu po vysadení DMT. Po pôrode je u žien s vysokou aktivitou ochorenia žiaduce sa čo najskôr vrátiť k pôvodnej liečbe, odporučila profesorka Tintoré. Základné odporúčanie u jednotlivých DMT ohľadom gravidity a dojčenia sú uvedené v tabuľke.
Nové lieky pre RR-SM
Profesorka Mar Tintoré sa venovala novo schváleným liekom, a to vrátane výsledkov ich registračných štúdií. Menovala ozanimod (Zeposia, inhibítor S1P1 a S1PS receptorov),
ponesimod (Ponvory, modulátor receptorov S1P1), ofatumumab (Kesimpta, monoklonálna protilátka s anti-CD20 pôsobením) a ublituximab (monoklonálna protilátka s anti-CD20 pôsobením, ktorá zatiaľ nemá registráciu ani v USA, ani v EÚ).
Progresívna SM
Pre progresívnu SM sú v súčasnosti registrované:
Ocrelizumab (Ocrevus) pre primárne progresívnu SM (PP-SM) bol schválený FDA v marci 2017 a EMA v januári 2018. V súčasnosti sú už dostupné aj sedemročné dáta z otvorenej extenzie štúdie (OLE), ktorá bola prezentovaná na kongrese Americkej neurologickej asociácie (74. AAN, apríl 2022). Nárast 48týždennej opakovane overovanej CDP (confirmed disability progression) podľa EDSS a kompozitnej CDP bol významne nižší (o 24 % a 25 %) u tých, ktorí zahájili liečbu ocrelizumabom skôr v porovnaní so skupinou s odloženou liečbou. Počas siedmich rokov bol nárast 48týždennej opakovanej CDP-9HPT a CDP-T25FW významne nižší (o 36 % a 27 %) u tých, ktorí zahájili liečbu ocrelizumabom skôr v porovnaní s liečbou odloženou. [7]
Siponimod (Mayzent), vysoko selektívny agonista pre receptory S1P1a S1P5, je prvý liek schválený pre sekundárne progresívnu SM. FDA ho schválila v marci 2019, EMA v januári 2020. V štúdii EXPAND preukázal siponimod superioritu oproti placebu: 21% redukciu CDPa 15% redukciu mozgovej atrofie.
Pacienti s neaktívnou SP-SM
Zostáva otázka, ako pristupovať k pacientom s neaktívnou SP-SM, ktorí vykazujú mierne horšie klinické liečebné výsledky ako pacienti s aktívnou SP-SM. Príkladom je štúdia EXPAND so siponimodom, kedy v celkovej študijnej populácii došlo za 42 týždňov k redukcii trojmesačnej CDP (oproti placebu) u 21 % liečených, ale u 31 % pacientov s aktívnou SP-SM (vs. placebo). Profesorka Tintoré upozornila, že priebeh je potrebné monitorovať, pretože fenotyp SM sa môže v čase meniť.
Otázka – liečiť, či neliečiť SP-M - býva nazývaná aj Zlatým grálom neurológie. Podľa profesora Gavina Giovannoniho (ECTRIMS 2001) sa v reálnych aj klinických štúdiách aktivita na MRI zdá byť citlivejším meradlom aktivity ochorenia v porovnaní s relapsami. V reálnom svete však môže predstavovať monitorovanie MRI u neliečených pacientov s „neaktívnou“ SP-SM problém, ktorý znižuje šancu na detekciu a liečbu akejkoľvek novej aktivity ochorenia. [8] Profesorka Tintoré k tomu uviedla, že príčinou „tichej“ progresie môžu byť pomaly rastúce lézie.
S cieľom ovplyvniť zápal v CNS
Pomaly sa zväčšujúce lézie sú do istej miery ovplyvnené dlhodobým zápalom, ktorý je prítomný od počiatku SM až do pokročilých fáz, aj keď s postupujúcim časom prevláda neurodegenerácia, ktorá je však tiež závislá od zápalu. Ako uviedla profesorka Tintoré, v tejto oblasti sa zdajú byť prípravky na princípe inhibície Brutonovej tyrozinkinázy (BTKI) veľmi nádejné. Brutonova tyrosinkináza (BTK) reguluje funkcie B lymfocytov a myeloidných buniek, ktoré sa podieľajú na patogenéze sclerosis multiplex. Evobrutinib je selektívny perorálny inhibítor BTK, u ktorého sa preukázalo, že inhibuje aktiváciu B-buniek in vitro aj in vivo. Výsledky klinickej štúdie fázy II s perorálnym evobrutinibom naznačujú, že by evobrutinib mohol ovplyvňovať mikroglia a makrofágy v CNS. [9]
V súčasnosti prebiehajú klinické štúdie s tolebrutinibom, ďalším BTKI (GEMINI a PERSEUS).
Proti neurodegenerácii
Masitinib je inhibítor tyrozinkináz, ktorý ovplyvňuje mastocyty a mikroglia. Predbežné výsledky klinickej štúdie naznačujú, že liečba masitinibom môže viesť k redukcii progresie EDSS a trojmesačnej CDP. [10]
Historicky sa skúšali u progresívnych foriem aj simvastatin, ibudilast či kyselina lipoová, ktorých predbežné výsledky v ovplyvnení rýchlosti atrofie mozgu sú sľubné, ale je nutné overiť ich ďalšími veľkými klinickými štúdiami. V štádiu overovania je protokol transplantácie autológnych mezenchymálnych buniek z kostnej drene.
Ageing population
Starne populácia svetová aj populácia pacientov s SM, chorí sa dožívajú vďaka liečbe vyššieho veku, dožijú sa aj komorbidít. Tak vek a senescencia imunitného systému, ako aj komorbidity majú vplyv na účinnosť a bezpečnosť DMT. „Do klinických štúdií sú v prevažnej väčšine zaraďovaní ľudia do 50, maximálne do 55 rokov. Pritom sú naši pacienti aj starší ako 65 rokov a my nevieme, ako podané lieky fungujú, “ povedala profesorka Tintoré. Preto je nutné usporiadať štúdie, ktoré by overili účinnosť, a predovšetkým bezpečnost DMT u seniorskej populácie. Profesorka Tintoré vyzdvihla význam reálnych dát z registrov, ktoré môžu upozorniť na riziká nežiaducich účinkov, vrátane onkologických ochorení, spojených s imunosupresívnou liečbou.
COVID-19 u pacientov s SM
Výsledky analýzy kohorty 5 543 pacientov (909 s podozrením na ochorenie a 4 634 s preukázaným ochorením COVID-19) potvrdili predchádzajúce rizikové faktory horšieho priebehu a klinických výsledkov infekcie SARS-CoV-2 u pacientov s SM: mužské pohlavie, vyšší vek, progresívna SM a vyššia disabilita boli spojené s horšími klinickými výsledkami. Liečba anti-CD20 DMT (ocrelizumabom a rituximabom) bola spojená s horším priebehom a výsledkami v porovnaní s glatiramer acetátom: zvýšené riziko hospitalizácie (aOR=1,61; 95% CI = 1,06-2,43; resp. aOR = 2,42; 95% CI = 1,54-3,81) a prijatia na JIS (aOR =3,13; 95% CI = 1,22-8,00; resp. aOR = 4,46; 95% CI = 1,64-12,09). Rituximab bol spojený so zvýšeným rizikom umelej ventilácie (aOR=3,57;95% CI = 1,38-9,20); ocrelizumab vykazoval nižšie riziko umelej ventilácie ako rituximab (aOR = 1,86; 95% CI = 0,76-4,55). Rituximab vykázal zvýšené riziko úmrtia (aOR = 2,74; 95% CI = 0,68-11,09). Tieto zistenia sa vzťahovali len na potvrdené prípady COVID-19. [11]
Postvakcinačná protilátková a bunková odpoveď: štúdia SAR-EM
Do štúdie bolo zaradených 457 pacientov. Pozorovania ukázali, že humorálna odpoveď sa znížila pri liečbe modulátormi sfingozín-1-fosfátového receptoru (S1PRM) a pri liečbe anti-CD20 prípravkami, s dlhším trvaním liečby. Odpoveď sa zvýšila po 4,5 mesiacoch od poslednej infúzie anti-CD20. Bunková odpoveď bola nižšia u pacientov, liečených S1PRM. U pacientov na liečbe anti-CD20 prípravkami môže byť zachovaná bunková odpoveď aj bez prítomnosti humorálnej odpovede (91,4 %). [12]
Odporúčanie ECTRIMS pre vakcináciu pacientov
Základné pravidlá:
- Overenie stavu imunitného systému bez ohľadu na terapeutický plán
- Informácie pacienta o význame vakcinácie a o riziku u neočkovaných pacientov; názory a priority pacienta by sa mali rešpektovať
- Vakcinácia by mala prebehnúť v čase diagnózy alebo v čo najvčasnejších štádiách ochorenia, aby sa predišlo odkladu zahájenia liečby DMT.
Vakcinácia pred podaním imunosupresie
- V súlade s regionálnymi štandardami a rizikami, vyplývajúcimi z liečby
- Inaktivované vakcíny sa môžu podať kedykoľvek, optimálne 2–3 týždne pred podaním imunosupresie
- Živé (oslabené) vakcíny sa smú aplikovať minimálne 4 týždne pred imunosupresiou
Imunosupresívne DMT: DMF, teriflunomid, modulátory S1P, natalizumab, cladribin, alemtuzumab a anti-CD20 prípravky.
Bezpečnosť očkovania
- Izraelská skupina udáva, že relaps zaznamenalo po prvej dávke vakcíny do štyroch mesiacov 3,1 %, čo je rovnaký podiel ako u neočkovaných.
- Analýza 102 pacientov plne očkovaných mRNA vakcínami vykázala u 5,9 % pseudo-relaps, ale nie skutočný relaps.
Význam biomarkerov (digitálnych, krvných a zobrazovacích)
(Role of biomarkers (digital, blood, imaging) in reshaping clinical MS research and daily care)
Prof. Dr. Ludwig Kappos, University Hospital and University of Basel, Švajčiarsko
Liečba sclerosis multiplex (SM): fázy vývoja
Svoju prezentáciu uviedol profesor Kappos výletom do histórie. Moderný výskum SM sa datuje od polovice dvadsiateho storočia a koncom dvadsiateho storočia už bolo jasné, že ide o autoimunitné ochorenie. K prvým používaným liekom patrili imunosupresíva a kortikosteroidy. Ďalej sa profesor Kappos venoval popisu historických míľnikov terapie SM.
Od imunosupresie k imunomodulácii (1960–1990)
Interferóny boli prvými účinnými imunomodulačnými liekmi, ktoré preukázali účinnosť v klinických štúdiách. V prvej štúdii (multicentrickej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii) s interferónom beta-1b (IFNβ-1b) u 372 ambulantných pacientov s relaps-remitujúcou sclerosis multiplex (RR-SM) IFNβ-1b preukázal svoju účinnosť v znižovaní počtu relapsov a počtu pacientov bez relapsu v porovnaní s placebovou skupinou. Efekt bol závislý od dávky, najviac z liečby profitovali pacienti s najvyššou dávkou IFNβ-1b. [13]
Zlatá éra klinických štúdií (1990–2020)
Ako príklad inovatívneho lieku uviedol profesor Kappos ocrelizumab, ktorého účinnosť a bezpečnosť bola overovaná v štúdiách OPERA I/II. Výsledky významne favorizujú ocrelizumab voči komparátoru. [14] Dôležité však je, že efekt ocrelizumabu nemizne v čase, o čom svedčia dlhodobé dáta (v roku 2022 už sedemročné). Ocrelizumab preukázal dlhodobý efekt aj u progresívnej SM; v štúdii ORATORIO bol porovnávaný s placebom. Efekt pretrvával aj v otvorenej fáze (OLE). [15]
Ďalším príkladom vysoko účinnej liečby je ofatumumab, ktorý bol skúmaný v dvoch klinických štúdiách s identickým dizajnom – ASCLEPIOS I/II. [16]
Jediný liek, schválený pre sekundárnu progresiu (SP-RS), siponimod, taktiež vykázal dlhodobú účinnosť, tak v samotnej klinickej štúdii (EXPAND), ako aj v jej extenzii. [17]
Nejde len o účinnosť, ale aj o bezpečnosť, upozornil profesor Kappos. Najmä pandémia COVID-19 nás poučila, že neradno podceňovať infekcie. Z tohto hľadiska je dlhodobé sledovanie všetkých pacientov zo štúdií s ocrelizumabom veľmi dôležité: riziko infekcie veľmi mierne narastá u pacientov s PP-SM, ale u chorých s RR-SM je v čase stabilné a nízke. [18]
Progresia nezávislá od relapsov (PIRA, Progression Independent from Relaps Activity)
Akumulácia disability môže nastať v súvislosti s relapsom (relapse activity worsening, RAW) alebo bez súvislosti s relapsom (PIRA). Predchádzajúce štúdie ukázali, že PIRA je častá, vyskytuje sa vo včasných štádiách SM, je bežná dokonca aj počas liečby vysoko účinnými prípravkami. V súbore reálnych dát u viac ako 27 000 pacientov s SM trvajúcou až 15 rokov u chorých s RR-SM viedla PIRA k postupujúcej disabilite častejšie ako RAW (47,3 % vs. 26,9 %). V metaanalýze klinických štúdií fázy III bola PIRA častejšia (34,5 % vs. 32,7 %) a viedla k progresii disability u 76,7 % až 77,7 % u SP-SM a u 83,4 % PP-SM. V týchto štúdiách bola PIRA menej častá u pacientov na DMT (11,4 % vs. 17,3 % u RR-SM; 18,5 % vs. 22,7 % u SP-SM; 32,1 % vs. 33,9 % u PP-MS). [19]
„Teraz je k dispozícii dostatok dôkazov, ktoré svedčia o tom, že progresia prebieha väčšinou nepozorovane bez zjavných relapsov,“ uviedol Kappos. SM je ochorenie s trvalo progresívnym, ale individuálnym priebehom. Táto progresia zostáva často nerozpoznaná. Úbytok mozgového tkaniva je do istej miery kompenzovaný plasticitou nervového tkaniva a kognitívnou rezervou, a to predstavuje progresiu do určitého štádia klinicky ťažko diagnostikovateľnú.
Biomarkery a ich význam
Digitálne biomarkery
Európska lieková agentúra definovala požiadavky na digitálne biomarkery, ktoré by mohli byť využité aj v klinických štúdiách:
- musia byť schopné objektívnej kvantifikácie fyziologických funkcií a/alebo chovania, aby mohli byť použité ako indikátor biologických, patologických procesov alebo odpovede na expozíciu či intervenciu,
- klinický význam musí byť založený na skutočnom vzťahu digitálnej technológie k existujúcim validovaným kritériám,
- potenciálne výhody digitálnych biomarkerov spočívajú vo vysokej časovej presnosti, sú získané z hlásení od samotných pacientov, alebo pasívnym monitorovaním a pokrývajú domény, ktoré sa inak dajú ťažšie hodnotiť, napríklad únavu, kogníciu a jemnú motoriku,
- digitálne biomarkery musia splňovať požiadavky na bezpečnosť a ochranu súkromia, ľahkosť ovládania, technickú spoľahlivosť, presnosť, týkajúcu sa intraindividuálnych zmien, obsahovú validitu, ako aj požiadavky na klinický význam.
Profesor Kappos uviedol niekoľko príkladov existujúcich a vyvíjajúcich sa digitálnych markerov:
MSCopilot (Francie), Floodlight (Roche), dreaMS.
Víziou do budúcnosti je zbierať dáta z aplikácií, MRI, klinických vyšetrení, ktoré potom umelá inteligencia vyhodnotí a vytvorí platformu k podpore klinického rozhodovania.
Zobrazovacie metódy
Odporúčané postupy vykonania a vyhodnotenia MRI vypracovala skupina expertov MAGNIMS (Magnetic Resonance Imaging in MS). Obsahuje odporúčané sekvencie zobrazení mozgu pre konkrétne stavy u pacientov s SM (diagnostika, monitorovanie, sledovanie bezpečnosti a pod.) a odporúčané intervaly medzi jednotlivými vyšetreniami MRI.
Profesor Kappos spomenul, že popis nálezu MRI vyžaduje veľkú skúsenosť a je časovo veľmi náročný. Prácu rádiológa potom môže uľahčiť automatizácia vyhodnotenia nálezu.
Frakcia myelínovej vody
Skutočné zmeny mozgového tkaniva objasní definitívne až patológ. Existuje biomarker pre detekciu rôznych typov lézií pri vyšetrení MRI (chronické aktívne lézie, fokálne meningeálne zápalové zmeny, strata axónov, kortikálne lézie)? Je normálne vyzerajúce mozgové tkanivo na MRI skutočne bez patológie? Ako biomarker axonálneho poškodenia môže slúžiť myelínová voda (myelin water imaging, MWI, zobrazovací biomarker pre myelín) kvantifikovaná viacplášťovým difúznym (multi-shell diffusion) zobrazením. Nálezy naznačujú, že patológia myelínu a axónov u SM je rozsiahla tak v léziách, ako aj v tkanive normálneho vzhľadu, pacienti s P-SM sa líšia od pacientov s RR-SM rozsiahlejším poškodením axónov/myelínu v kôre; patológia myelínu a axónov v léziách súvisí s disabilitou. [20]
Biomarkery chronických lézií a remyelinizácia
Stále však pretrváva problém identifikovať špecifické typy chronických, najmä remyelinizovaných lézií in vivo u pacientov s SM. V citovanej štúdii (uverejnenej 17. júna 2022. doi: 10.1002/ana.26441) autori preukazujú, že vyšetrenie (na triteslovej MRI): kvantitatívneho mapovania citlivosti (QSM), myelínovej vodnej frakcie (MWF), mapy indexu hustoty neuritov (NDI) koreluje s post mortem nálezmi. [21]
U sclerosis multiplex (SM) môžu byť chronické aktívne lézie identifikované pomocou susceptibility-based MRI in vivo ako gadolinium neenhacujúce lézie s paramagnetickými okrajmi (PRL). Patologicky sa prejavujú ako smoldering lézie s aktívnymi okrajmi, nedostatočnej remyelinizácie a axonálnej degenerácie. Citovaná štúdia preukázala, že chronické aktívne lézie sú bežné, sú spojené s agresívnejším ochorením, spôsobujú progredujúce poškodenie tkaniva a vyskytujú sa dokonca aj u jedincov, liečených účinnými DMT. [22]
Chronické aktívne lézie SM, charakterizované hyperintenzívnym lemom s vysokým obsahom železa, s aktivovanými mikrogliami a makrofágmi, boli spojené s väčším poškodením tkaniva. Štúdie post mortem zistili, že chronické aktívne lézie primárne súvisia s vyššími štádiami SM; ale zdá sa, že smoldering a aktívne lézie sú prítomné v ranných štádiách SM. Pri histopatologickom vyšetrení vykazovali chronické aktívne aj smoldering lézie závažnejšie axonálne poškodenie na okraji lézie ako v centre. Chronický zápal bielej hmoty bol spojený so zvýšenými koncentráciami sNfL a väčšou závažnosťou ochorenia, čo naznačuje, že PRL prispieva ku klinicky relevantnej neurodegenerácii, ku ktorej dochádza v dôsledku zápalu. [23]
S technickým zdokonaľovaním prístrojov MRI (7 T) sa dajú identifikovať kortikálne lézie, ktoré majú taktiež prediktívny charakter. Vyšší počet kortikálnych lézií predpovedá kratší čas do SP-SM. Pre znázornenie kortikálnych lézií existujú už nástroje automatickej detekcie. [24]
Ľahké reťazce neurofilament
O tomto biomarkery sa hovorí už niekoľko rokov, ale zatiaľ si nenašiel miesto v rutinnej praxi, pretože chýbajú overené kritériá, odpovedajúce veku pacienta, štádiu a dĺžke trvania SM.
Koncentrácie ľahkých reťazcov neurofilament (NfL) v likvore a sére prísne korelujú. Ich zvyšujúca sa koncentrácia je spojená so súčasným aj budúcim relapsom a progresiou disability a sprevádzajú vznik mozgových a miešnych lézií a atrofie.
Leppart s kolegami zistil, že vyššie koncentrácie sérových NfL sú spojené s budúcou progresiou disability a stupňom atrofie mozgu bez ohľadu na prítomnosť alebo neprítomnosť súčasnej aktivity ochorenia (gadolinium enhancujúce lézie alebo nedávny relaps). Koncentrácie sérových pNfL boli nižšie u pacientov, liečených siponimodom alebo fingolimodom oproti pacientom na placebe, a vyššie u pacientov, u ktorých došlo k progresii disability (analýza štúdií EXPAND a INFORMS). [25]
Bez validácie referenčných hodnôt koncentrácie NfL sa však toto kritérium nedá využiť ako diagnosticko-prognostický marker v klinickej praxi.
Záverom profesor Kappos upozornil, že biomarkery je nutné overovať vo veľkých klinických štúdiách, aby mohli slúžiť ako kritériá pre posudzovanie účinnosti liečby. Dlhodobé štúdie musia vychádzať nielen z dát randomizovaných študií fázy II a III, ale aj z dát reálnej praxe.
Biomarkery sú veľmi dôležité pre klinické rozhodovanie, a preto musia byť spoľahlivé a aplikovateľné na širokú populáciu pacientov s SM.
Literatura
[1] Tintore M, et al. Effect of Changes in MS Diagnostic Criteria Over 25 Years on Time to Treatment and Prognosis in Patients With Clinically Isolated Syndrome. Neurology. 2021 Sep.
[2] Iaffaldano P. Early treatment delays long-term disability accrual in RRMS: Results from the BMDS network. Mult Scler J. 2021.
[3] Tremlett H, et al. The multiple sclerosis prodrome is just unspecific symptoms in radiologically isolated syndrome patients – No. Mult Scler J. 2021(27) 12:1824-1826.
[4] Ontaneda D, et al. Determining the effectiveness of early intensive versus escalation approaches for the treatment of relapsing-remitting multiple sclerosis: The DELIVER-MS study protocol. Contemp Clin Trials. 2020 Aug;96:106009.
[5] He A, et al. Timing of high-efficacy therapy for multiple sclerosis: a retrospective observational cohort study. Lancet Neurol. 2020 Apr;19(4):307-316).
[6] Rotstein D, et al. Association of No Evidence of Disease Activity With No Long-term Disability Progression in Multople Sclerosis: A Systematic Review an Meta-Analysis, Neurology. April 26, 2022, DOI: https://doi.org/10.1212/WNL.0000000000200549.
[7] Kappos L, et al. Repeated Confirmed Disability Progressions Analyses of the OPERA and ORATORIO Studies and Their Open‑Label Extensions. Presented virtual at the 74th Annual Meeting of the American Academy of Neurology (AAN), 2022 April 24–26, 2022; Poster number P7.4‑002.
[8] Giovannoni G, et al. MRI activity versus relapses as markers of disease activity in SPMS: Data from real world and pivotal clinical studies. ECTRIMS 2021. P001.
[9] Montalban et al. Placebo-Controlled Trial of an Oral BTK Inhibitor in Multiple Sclerosis. N Engl J Med 2019;380:2406-2417.
[11] Simpson-Yap S. Results of the COVID-19 in MS global data sharing initiative validate consistent associations of anti-CD20 and other reported risk factors with severe COVID-19 outcomes. ECTRIMS 2021.
[12] Zabalza A, et al. Is humoral and cellular responses to SARS-CoV-2 vaccine modified by DMT in patients With Multiple Sclerosis and other autoimmune deseases? Mult Scler 2022 Jun;28(7):1138-1145.
[13] The IFNB Multiple Sclerosis Study Group. Interferon beta-1b is effective in relapsing-remitting multiple sclerosis. I. Clinical results of a multicenter, randomized, double-blind, placebo-controlled trial. Neurology 1993;43:655-61.
[14] Hauser S, Kappos L, et al. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. New Engl J Med. 2017 2017; 376:221-234.
[15] Wolinsky JS, et al. Long-term follow-up from the ORATORIO trial of ocrelizumab for primary progressive multiple sclerosis: a post-hoc analysis from the ongoing open-label extension of the randomised, placebo-controlled, phase 3 trial. Lancet Neurol. 2020 Dec;19(12):998-1009.
[16] Hauser SL, et al. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N ENGL J Med; 2020; 383:546–57.
[17] Kappos L, et al. ePresentation EPR2128 at EAN 2020.
[18] Hauser SL, et al. Safety of Ocrelizumab in aprtients With Relapsing and Primary Progressive Multiple Sclerosis. Neurology 2021; 96 (16):1546–1559.
[19] Lublin FD et al. How patients with multiple sclerosis acquire disability. Brain 2022 Feb 1; [e-pub]. (https://doi.org/10.1093/brain/awac016.)
[20] Rahmanzadeh R, et al. Myelin and axon pathology in multiple sclerosis assessed by myelin water and multi-shell diffusion imaging. Brain. 2021 Jul 28;144(6):1684-1696.
[21] Rahmanzadeh R, et al A new advenced MRI biomarker identifies fully remyelinated lession in MS. Annals of neurology. 17. June. 2022. https://doi.org/10.1002/ana.26441
[22] Absinta M, et al. Association of Chronic Active Multiple Sclerosis Lesions With Disability In Vivo. JAMA Neurol. 2019;76(12):1474-1483.
[23] Maggi P, et al.Chronic White Matter Inflamation and Serum Neurofilament Levels in Multpple Sclerisis. Neurology, 2021; 97 (6): e543-e553.
[24] Rosa F, et al. Multiple sclerosis cortical and WM lesion segmentation at 3T MRI: a deep learning method based on FLAIR and MP2RAGE. Neuroimage Clin; 2020 Vol 27, 102335.
[25] Leppert D, et al. Blood Neurofilament Light in Progressive Multiple Sclerosis. Post Hoc Analysis of 2 Randomizes Controlled Trials. Neurology 2022; 98 (21).