Sedemročné výsledky otvorenej predĺženej štúdie Glatiramer Acetate Low-frequency Administration (GALA)

Dlhodobá účinnosť a bezpečnosť režimu dávkovania glatiramer acetátu trikrát týždenne u pacientov s relaps remitentnou sclerosis multiplex
Cieľom autorov práce, ktorá bola uverejnená v decembri 2021 v časopise Multiple Sclerosis Journal – Experimental, Translational and Clinical, bolo overiť dlhodobé výsledky liečby s včasným zahájením (early-start, ES) a s odloženým začiatkom (delayed-start, DS) glatiramer acetátom 40 mg/ml trikrát týždenne (GA40) po dobu až siedmich rokov v rámci extenzie štúdie GALA (Glatiramer Acetate Low-frequency Administration) (GALA) u pacientov s relaps remitentnou sclerosis multiplex (RR-SM).
Štúdia GALA bola navrhnutá pre overenie účinnosti a bezpečnosti GA40 ako dvanásťmesačná, multicentrická, dvojito zaslepená, placebom kontrolovaná klinická štúdia fázy III. Ukázalo sa, že menej častý režim dávkovania GA40 má profil účinnosti a bezpečnosti podobný ako u zavedeného režimu denného dávkovania 20 mg/ml (GA20).
Po ukončení zaslepenej fázy prešli pacienti do otvorenej štúdie (open-label extention, OLE), v ktorej boli všetci liečení GA40. Pacienti boli hodnotení každé tri až šesť mesiacov.
Primárnym cieľovým parametrom účinnosti bol ARR (ročná miera relapsov)
Pre účinnosť boli pre kohorty ES a DS použité údaje z celého obdobia expozície. Pre sledovanie bezpečnosti sa do úvahy brala len expozícia GA40.
Z pacientov, ktorí pokračovali do OLE, dokončilo sledovanie 580/834 (70 %) v skupine ES a 261/419 (62 %) v skupine DS. Počas celého obdobia placebom kontrolovanej a OLE štúdie bolo ARR 0,26 u pacientov skupiny ES a 0,31 u skupiny DS (HR = 0,83; 95% CI: 0,70–0,99). ES predĺžil stredný čas do prvého relapsu oproti DS (4,9 vs. 4,3 roku; HR = 0,82; 95% CI: 0,6–0,96).
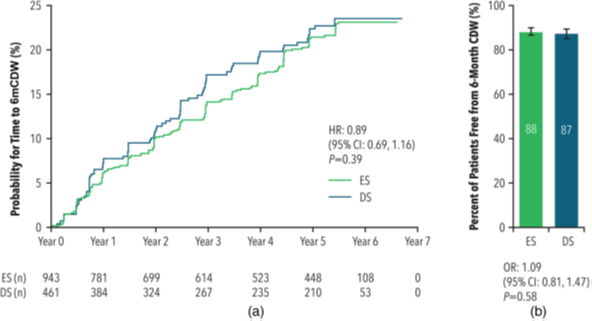
Čas do šesťmesačného potvrdenia zhoršenia disability (6mCDW) a percento pacientov bez progresie disability (6mCDW free)
Počas celého obdobia štúdie placebom kontrolovanej a otvorenej fázy (placebo controlled and open and open-label extention, PC and OLE) mali pacienti v kohorte ES približne rovnako dlhý čas do 6mCDW v porovnaní s kohortou DS (HR = 0,89; 95% CI: 0,69–1,16; p = 0,39) (viz graf a). Čas do 6mCDW len počas obdobia OLE sa nelíšil podľa liečebnej skupiny (HR = 1,11; 95% CI: 0,82–1,50; p = 0,49).
Percento pacientov, ktorí zostali bez progresie (6mCDW free), bolo v priebehu celého obdobia štúdie PC a OLE podobné východiskovému stavu (88 % v skupine ES a 87 % v kohorte DS; OR = 1,09; 95% CI: 0,81–1,47; p = 0,58) (viď graf b). Percento pacientov, ktorí vykázali 6mCDW len počas obdobia OLE, sa nelíšilo podľa liečebnej skupiny (17 % u ES vs. 15 % u DS; OR = 1,22; 95% CI: 0,88–1,70; p = 0,22).
Zmena EDSS od východiskovej hodnoty počas celého obdobia štúdie PC a OLE
Priemerné hodnoty EDSS na začiatku boli 2,81 pre ES a 2,75 pre DS. Počas celého obdobia štúdie PC a OLE bola priemerná zmena od východiskovej hodnoty podobná u ES aj DS. Na konci prvého roku bola priemerná zmena v skupine ES −0,09 (± 0,03) a skupine DS −0,06 (± 0,04) s priemerným rozdielom −0,03 (95% CI: − 0,12–0,06; p = 0,52). Na konci siedmeho roku bola priemerná zmena tiež podobná tak v skupine ES 0,25 (± 0,05), ako aj v skupine DS 0,24 (± 0,07) s rozdielom 0,01 (95% CI: −0,14–0,17; p = 0,85).
Percento pacientov so stabilným alebo zlepšeným skóre EDSS bolo medzi kohortami podobné počas celého obdobia štúdie, rovnako ako percento pacientov, ktorí dosiahli EDSS 4 a EDSS 6. Podobne sa čas k dosiahnutiu skóre EDSS 4 alebo 6 medzi skupinami významne nelíšil.
Nežiaduce účinky boli v súlade so známym, dobrým a trvalým bezpečnostným profilom GA.
Záver: Liečba GA40 mala klinický prínos po dobu siedmich rokov, čo potvrdzuje trvalú účinnosť GA40. Terapia bola u pacientov s RR-SM všeobecne dobre tolerovaná.
Graf. Čas do šesťmesačného potvrdenia zhoršenia disability (6mCDW) a percento pacientov bez progresie disability (6mCDW free)
Vysvetlivky v texte
Zdroj:
Rieckmann P, et al. Multiple Sclerosis Journal – Experimental, Translational and Clinical. October–December 2021, 1–9, DOI: 10.1177/20552173211061550